横山研究室の研究紹介
(Last update 2023.4)
─生体膜シグナリングタンパク質や創薬ターゲットタンパク質の構造生物学─
タンパク質の立体構造を決定することでタンパク質の機能を解明することを目指しています。
タンパク質分子の形を見るために、対象とするタンパク質を大腸菌や昆虫細胞等に発現させ、
タンパク質を精製します。
精製したタンパク質を規則的に配列した結晶を作製し、結晶にX線を照射して得られる回折像を解析して
タンパク質の構造を決定します。
現在以下のような研究を進めています。
1. 生体膜シグナリングタンパク質の機能解明を目指した構造生物学研究
・溶血性貧血の原因タンパク質 stomatin
・腎臓ネフローゼ症候群の原因タンパク質 podocin
2. 抗がん剤設計を目指したタンパク質-阻害剤の結合様式の解明
・キネシン CENP-E ─ 阻害剤複合体(静岡県立大学 創薬探索センター 浅井 教授、澤田 准教授との共同研究)
(Acta Crystallog. D 2021、
FEBS Lett. 2023、
プレスリリース230403)
・細胞間接着装置の主要構成因子 Claudin ─ 化合物複合体(岐阜薬科大学 薬学部 五十里 教授との共同研究)
・多発性骨髄腫関連 Signaling lymphocytic activation molecule family 7 (SLAMF7) ─ 抗体複合体
Protein Data Bank (PDB, タンパク質構造のデータベース) ID:
6M4I
(学内共同研究)
・Ir錯体─ calmodulin複合体(青木研究室との共同研究)
・Matrix metalloproteinase 21 (MMP21) (生命研 昆研究室との共同研究)
・Glyoxalase I (GLO I) ─ 阻害剤複合体(高澤研究室との共同研究)
(FEBS Lett. 2022)
・Poly(ADP-ribose) glycohydrolase (PARG) ─ 阻害剤複合体(総研 田沼研究室との共同研究)
・Mitochondrial intermediate peptidase (MIPEP) ─ 基質複合体(樋上研究室との共同研究)
・Phosphoinositide 3-kinase (PI3K) ─ caffeine複合体、
Poly(ADP-ribose) polymerase-1 (PARP1) ─ caffeine代謝物複合体(青山研究室、河野洋平 先生との共同研究)
PDB ID:
7WT2
7WT0
7WT1
7WSZ
こ
れまでには以下のような研究を行ってきました。
1. 生体膜シグナリングタンパク質の構造機能解明
(1) 生体膜結合タンパク質ストマチンとその特異的切断プロテアーゼによる制御機構の解明(現在も進行中です。)
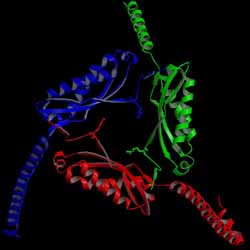 ストマチンは、ヒトの赤血球膜上で発見され、イオンチャネルの活性を制御する膜タンパク質です。
その欠損は溶血性貧血(遺伝性有口赤血球症 stomatocytosis)の原因となると報告されています。
ストマチンの原子レベルでの構造と機能の解明により、溶血性貧血の発症メカニズムの解明や治療薬開発にも
貢献できると考え研究を進めています。
ストマチンは、ヒトの赤血球膜上で発見され、イオンチャネルの活性を制御する膜タンパク質です。
その欠損は溶血性貧血(遺伝性有口赤血球症 stomatocytosis)の原因となると報告されています。
ストマチンの原子レベルでの構造と機能の解明により、溶血性貧血の発症メカニズムの解明や治療薬開発にも
貢献できると考え研究を進めています。
これまでに超好熱菌ストマチンのコアドメインの立体構造を決定しました。図のようにホモ三量体の
新規構造でした。
(J. Mol. Biol. 2008,
Yakugaku Zasshi 2010)
一方、一方マウスのストマチンのコアドメインの立体構造はホモ二量体であり、二量体か三量体かを決定する領域はどこかについて解明しました。
(Biochem. Biophys. Rep. 2022)
またストマチンの多量体構造モデルを作成しました。
(FEBS Open Bio 2023)
超好熱菌の膜結合プロテアーゼは超好熱菌のストマチンを特異的に切断します。
この切断反応が何らかの制御機構と関係していると考えられます。プロテアーゼ単体、及び基質ペプチド
との複合体の立体構造を決定したところ、両者が大きく構造変化していることが分かりました。
(J. Biol. Chem. 2005,
J. Mol. Biol. 2006,
J. Synchrotron. Rad. 2008,
Biochemistry 2012,
J. Synchrotron. Rad. 2013,
Acta Crystallog. D 2020)
またこのプロテアーゼのC末にはOB(Oligosaccharide/oligonucleotide Binding)-foldドメインがあり
多量体を形成することが分かりました。プロテアーゼはこのドメインを介して多量体を形成し、必要に応じて
ストマチンを切断して制御すると考えられます。
(Biochimie 2013,
FEBS Open Bio 2014)
(産業技術総合研究所 松井 博士との共同研究)
PDB ID:
3BK6
2DEO
3BPP
3VIV
3WG5
3WWV
6M4B
8GN9
(2) オリゴペプチド結合タンパク質OppAによるペプチド結合と輸送機構の解明
細菌のオリゴペプチド結合タンパク質(オリゴペプチドパーミアーゼ、Opp)は
ペプチドの結合と輸送による情報伝達に関わっています。この機構を抑えることで細菌感染症対策のターゲット
となると考えられます。この細胞外ペプチド結合サブユニットOppAの構造、およびそのペプチド結合と輸送機構の解明を目指して
研究を進めました。
(Crystallogr. Rep. 2021,
Proteins: Struct Funct Bioinf. 2022)
PDB ID:
7FI3
2. 創薬ターゲットタンパク質:細胞分裂期特異的モーターEg5の阻害剤結合様式の解明
キネシンEg5はATP駆動性モータータンパク質であり、Eg5の機能阻害により細胞分裂が停止し
細胞死が誘導されます。Eg5阻害剤は非分裂期の微小管には作用しないため、神経毒性の少ない細胞分裂阻害剤、
すなわち抗がん剤の標的分子として注目されています。
ATP競合阻害様式を示すbiphenyl化合物とEg5モータードメインとの複合体の立体構造を決定しました。
(ACS Chem. Biol. 2015)
本研究は、アロステリック型ATP競合阻害剤の開発に重要な構造基盤を提供すると考えています。
さらに不競合阻害剤であるSTLC-type阻害剤 PVEI0021、PVEI0138とEg5モータードメインとの複合体の立体構造を決定しました。
(ACS Omega 2018)
(いずれも静岡県立大学 創薬探索センター 浅井 教授、澤田 准教授との共同研究)
PDB ID:
3WPN
5ZO7
5ZO8
5ZO9
3. 金属結合タンパク質HP-NAPの金属イオン取り込み機構の解明
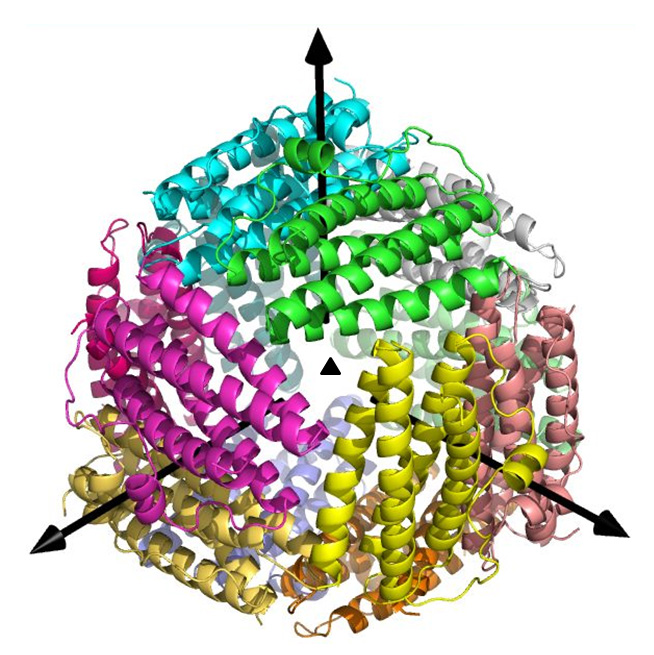 Helicobacter pylori の感染は胃粘膜に好中球浸潤を伴う胃炎を引き起こします。
H. pyloriが産生する好中球活性化タンパク質(HP-NAP)は活性酸素の産生を増大させるため、
がんを引き起こす病原因子の1つと考えられています。
HP-NAPは球状の鉄貯蔵タンパク質でその大きな内空隙に鉄原子を取り込み貯蔵します。
このHP-NAPの金属イオン取り込み機構を解明するため、鉄、亜鉛、カドミウム結合体、
およびアポ体の立体構造を決定しました。
(Acta Crystallog. F 2012,
Biochem. Biophys. Res. Commun. 2012,
Biomolecules 2014)
Helicobacter pylori の感染は胃粘膜に好中球浸潤を伴う胃炎を引き起こします。
H. pyloriが産生する好中球活性化タンパク質(HP-NAP)は活性酸素の産生を増大させるため、
がんを引き起こす病原因子の1つと考えられています。
HP-NAPは球状の鉄貯蔵タンパク質でその大きな内空隙に鉄原子を取り込み貯蔵します。
このHP-NAPの金属イオン取り込み機構を解明するため、鉄、亜鉛、カドミウム結合体、
およびアポ体の立体構造を決定しました。
(Acta Crystallog. F 2012,
Biochem. Biophys. Res. Commun. 2012,
Biomolecules 2014)
鉄結合構造とアポ体構造では主要鉄結合部位であるferroxidase centerにおいて鉄結合に関与する残基の
構造が変化していることが分かりました。また負に帯電したpore中に金属結合が認められたので
このporeが金属イオンの通路であると考えられます。
PDB ID:
3T9J
3TA8
4EVB
4EVC
4EVD
4EVE
4. 紫外線損傷DNAの特徴的な構造とその特異的抗体による認識機構の解明
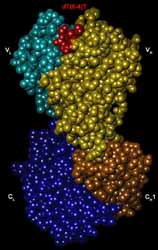 DNAは紫外線の照射により様々な損傷を受け、それが突然変異や細胞の癌化につながることが知られています。
そのような損傷DNAの1つである(6-4)光産物は、高い突然変異誘発能を示すことが報告されています。
DNAは紫外線の照射により様々な損傷を受け、それが突然変異や細胞の癌化につながることが知られています。
そのような損傷DNAの1つである(6-4)光産物は、高い突然変異誘発能を示すことが報告されています。
そこで(6-4)光産物を認識する抗体のFabと(6-4)光産物との複合体の立体構造を決定し、
(6-4)光産物の特徴的な構造と、抗体による(6-4)光産物認識機構を明らかにしました。
(J. Mol. Biol. 2000,
Acta Crystallog. D 2012,
Acta Crystallog. D 2013,
Int. J. Mol. Sci. 2014,
Acta Crystallog. F 2019,
Sci. Rep. 2019)
PDB ID:
1EHL
1KEG
3VW3
6IDG
6IDH
6KDH
6KDI
 ストマチンは、ヒトの赤血球膜上で発見され、イオンチャネルの活性を制御する膜タンパク質です。
その欠損は溶血性貧血(遺伝性有口赤血球症 stomatocytosis)の原因となると報告されています。
ストマチンの原子レベルでの構造と機能の解明により、溶血性貧血の発症メカニズムの解明や治療薬開発にも
貢献できると考え研究を進めています。
ストマチンは、ヒトの赤血球膜上で発見され、イオンチャネルの活性を制御する膜タンパク質です。
その欠損は溶血性貧血(遺伝性有口赤血球症 stomatocytosis)の原因となると報告されています。
ストマチンの原子レベルでの構造と機能の解明により、溶血性貧血の発症メカニズムの解明や治療薬開発にも
貢献できると考え研究を進めています。 Helicobacter pylori の感染は胃粘膜に好中球浸潤を伴う胃炎を引き起こします。
H. pyloriが産生する好中球活性化タンパク質(HP-NAP)は活性酸素の産生を増大させるため、
がんを引き起こす病原因子の1つと考えられています。
HP-NAPは球状の鉄貯蔵タンパク質でその大きな内空隙に鉄原子を取り込み貯蔵します。
このHP-NAPの金属イオン取り込み機構を解明するため、鉄、亜鉛、カドミウム結合体、
およびアポ体の立体構造を決定しました。
(Acta Crystallog. F 2012,
Biochem. Biophys. Res. Commun. 2012,
Biomolecules 2014)
Helicobacter pylori の感染は胃粘膜に好中球浸潤を伴う胃炎を引き起こします。
H. pyloriが産生する好中球活性化タンパク質(HP-NAP)は活性酸素の産生を増大させるため、
がんを引き起こす病原因子の1つと考えられています。
HP-NAPは球状の鉄貯蔵タンパク質でその大きな内空隙に鉄原子を取り込み貯蔵します。
このHP-NAPの金属イオン取り込み機構を解明するため、鉄、亜鉛、カドミウム結合体、
およびアポ体の立体構造を決定しました。
(Acta Crystallog. F 2012,
Biochem. Biophys. Res. Commun. 2012,
Biomolecules 2014) DNAは紫外線の照射により様々な損傷を受け、それが突然変異や細胞の癌化につながることが知られています。
そのような損傷DNAの1つである(6-4)光産物は、高い突然変異誘発能を示すことが報告されています。
DNAは紫外線の照射により様々な損傷を受け、それが突然変異や細胞の癌化につながることが知られています。
そのような損傷DNAの1つである(6-4)光産物は、高い突然変異誘発能を示すことが報告されています。