研究紹介
OUR RESEARCH
当研究室での研究の概要
がんは生体内の環境に適応し、増殖や生存を維持します。近年、がんに関するビッグデータの解析やカタログ化が進み、種々のがんが持つ特徴があぶり出され、治療法の開発につなげられてきていますが、がんのなかには未だに特別な治療法が存在しないものもあります。当研究室では、基礎生物学的手法を用いてがんの脆弱性を探索し、がんの治療標的(分子・経路)の発見と、治療法の開発につなげることを目標とした研究を進めています。がん抑制のために、標的細胞を細胞死へ誘導する手法だけではなく、細胞老化へ誘導する手法を採用する取り組みも行っており、下記のように大きく分けて二つのテーマの柱を立てて研究を進めています。
がん細胞のテロメア維持機構を標的とした
がん抑制方法の開発
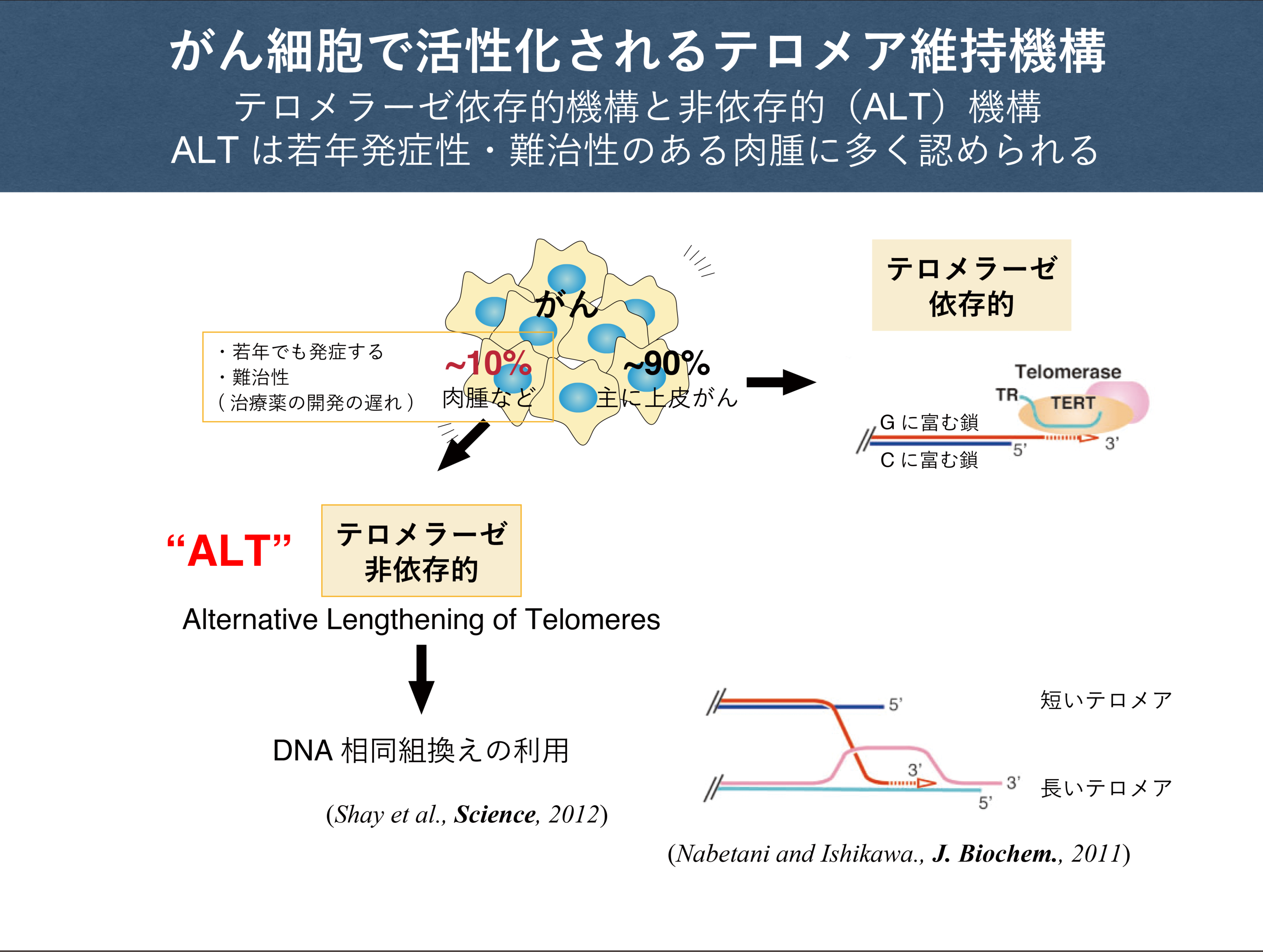
テロメアは真核生物がもつ線状染色体の両末端にある特殊な蛋白質-DNA複合体で、DNA消化酵素から染色体を保護したり、染色体同士が連結されてしまうのを防いだりする機能を持っています。テロメアが失われたり機能しなくなったりすると、遺伝情報の消失や染色体の連結と破壊が起こる可能性が高まるため、細胞は増殖を止めたり死んだりします。一方で、テロメアは細胞分裂のたびに(DNA複製のたびに)徐々に短くなる性質を持つことが知られており、増殖を続ける必要のある細胞では、テロメアを一定に保つための生体反応が起きるようになっています。この反応がテロメア維持機構と呼ばれるもので、テロメラーゼと呼ばれる酵素、またはDNA相同組換え機構によって担われています。正常な個体の中では、テロメア維持機構が働いているのは、増殖する必要性のある細胞(幹細胞と生殖系列の細胞)に限られており、その他の細胞ではテロメア維持機構が働かなくなっていて、一定回数分裂を繰り返すと、意図的に増殖しなくなるように仕組まれています。がん細胞は、この仕組みに逆らってテロメア維持機構を活性化させて、無限に増殖する能力を獲得しています。そして正常細胞の住む場所や栄養をむしばみ、個体として健康に生きる力を奪っていきます。
つまり、がん細胞はテロメア維持機構に依存して永久なる増殖を達成しています。したがって、この維持機構を阻害する方法や、阻害するのに有効な物質を見出すことができれば、すなわちそれはがん治療法の開発につながることが期待されます。当研究室では、テロメア維持機構のうち、DNA相同組換えを使う方法(ALT機構と呼ばれます)で増殖を維持するがんに注目して、その維持機構や細胞増殖の抑制手法の発見を目指します。これまでの研究で、私たちは、京大、理研、東大、産総研、がん研の協力を得て、ALTがん細胞の増殖や、ALT機構を選択的に阻害する化合物の選抜を行いました。今後は、これらの化合物が、どのようなメカニズムでALTがん細胞の増殖やALT機構を阻害するのかを協力しあって調べていきます。もしALTがん細胞の増殖が選択的に阻害される分子機構、ALT機構が阻害される分子機構を明らかにすることができれば、当学科内外との共同研究を通じて、マウス個体を利用した薬効評価試験を実施したり、化合物の改変と最適化を行ったりして、その後理想的には臨床研究につながる段階まで進めて行きたいと思っています。
最近の研究から、ALTがん細胞に共通する遺伝子変異があることがわかりました。この遺伝子はヘテロクロマチン(凝縮したクロマチン)の維持に関わることが明らかにされていて、機能を失うことでテロメアを含むヘテロクロマチンが緩み、テロメアがDNA相同組換え反応を受けやすくなると考えられています。当研究室では、ALTがん細胞の増殖やALT機構を阻害する化合物の作用機序解析と並行して、ALTがん特異的な遺伝子変異をALTがん細胞の弱点ととらえ、ATR-X変異を持った細胞のみを狙い撃ちできる化合物などの選抜も新たに開始したいと思っています。
ALTによるテロメア維持機構は、若年発症性があり、特別な治療薬がない「肉腫」と呼ばれるタイプのがんで使われる頻度が高いことが知られています。臨床がん症例のうち90%はテロメラーゼを使って増殖するがんで、ALT機構を使って増殖するがんは10%だと言われているので、ALTがんは治療法開発の対象としては注目されにくい(患者数が比較的少ないから)部類のがんかもしれません。また、肉腫は希少がんに分類されていますし、忘れられたがんとも称されています。それでも骨肉腫だけでも年間200~300人の発症が認められるそうですし、「若年」発症性があるという性質は治療法開発の対象として注目すべき点だと思われます。こういったがんこそアカデミックな研究の場で治療への道を切り拓いていくべきものだと考えます。
細胞老化の仕組みの解明と
細胞老化を利用したがん抑制方法の開発
細胞老化とは、細胞が、生存したまま不可逆的に増殖を停止することであり、さまざまな細胞傷害性のストレスが引き金となって誘導されます。一般にこれらのストレスはDNA損傷を引き起こし、p53やRbというよく知られているがん抑制蛋白質を介して細胞の増殖を停止させると考えられています。これまでに、細胞老化は加齢に伴う組織の機能低下の原因になり得ることが報告されています。また、細胞老化はがん遺伝子の異常な活性化に応答して誘導されることから、がん抑制機能ももつと考えられています。細胞増殖停止の不可逆性は、修復できないDNA損傷が核内に残り続けることで達成されると考えられていますが、不可逆性がどのように保証されているかは不明です。また、DNA損傷がなくても細胞が老化する可能性も示唆されていることから、細胞老化による増殖停止の不可逆性の分子メカニズムは実はあまり良くわかっていないと言えます。
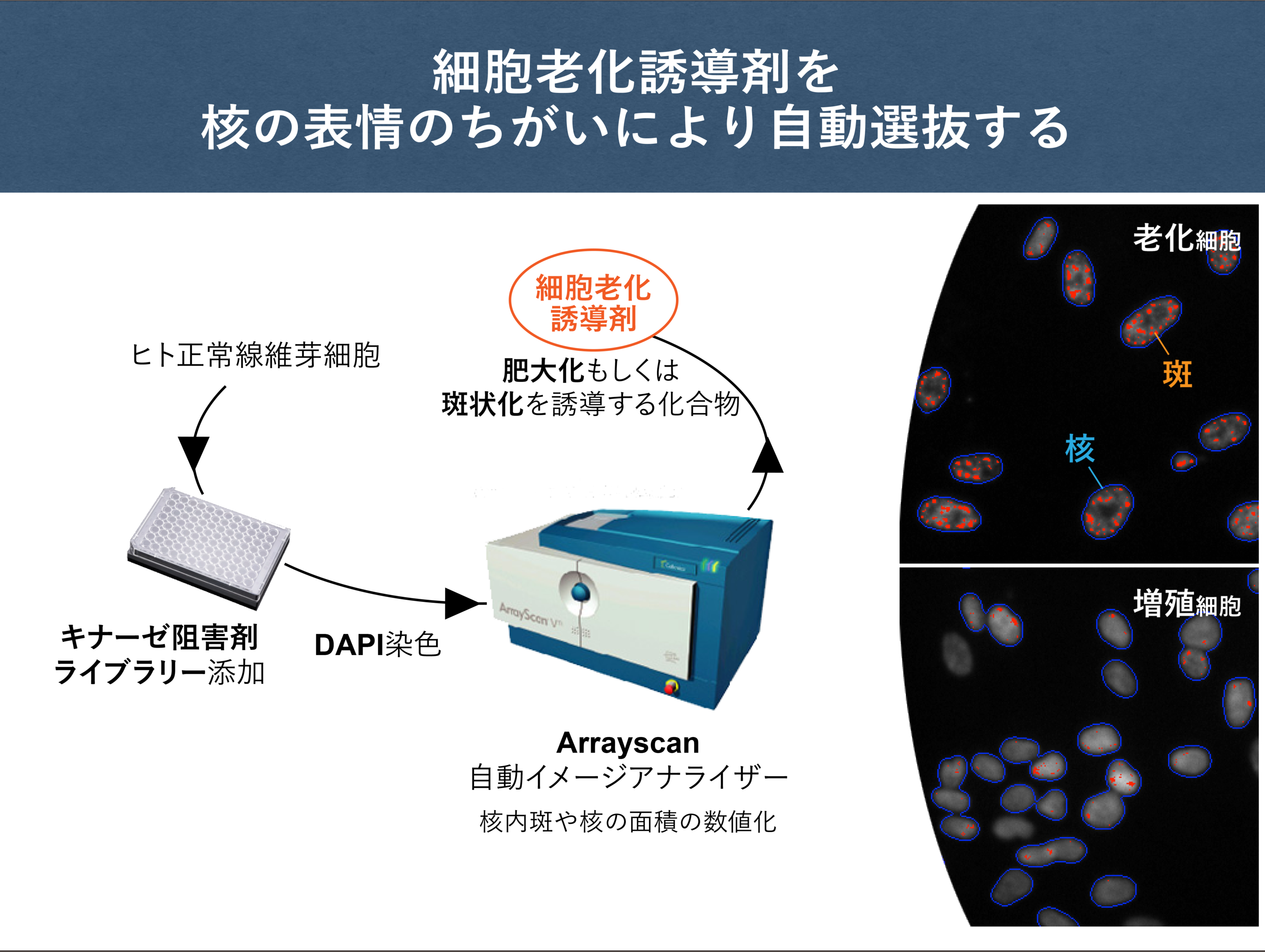
これまでの私たちとCancer Research UKとの共同研究で、細胞老化誘導に関わる因子を網羅的に同定する目的で、老化した細胞に特徴的な核形態の変化をもたらす化合物の選抜を行いました。そのうちの一部については、すでに細胞老化を誘導する能力を持つことを確認しており、核の形態変化を見ることで細胞老化誘導剤を取得できるという目的が達成されました。
これまでに取得された老化誘導剤の中から、細胞周期M期に核と細胞の分裂を阻害し、四倍体細胞(ヒト細胞は通常二倍体)を生じさせる化合物が見つかりました。四倍体細胞はそのまま分裂し続けると、がん細胞を生み出す危険を持つことから、細胞老化が四倍体細胞の増殖を不可逆的に停止することによって、がん細胞の出現を抑えていると考えることが可能です。しかしこのタイプの細胞老化において、何が引き金になって細胞老化が誘導されているのか、老化に関わる因子は何かが依然としてわかっていないので、今後の研究で明らかにしていきたいと思っています。また、ここに挙げた老化誘導剤以外にも取得された化合物があって、それらは細胞老化に伴うクロマチンの核内配置変化を促進するものだと予想されますので、化合物の標的蛋白質の特定と、細胞老化誘導の分子メカニズムの解明を実施したいと考えています。
細胞老化誘導剤を選抜する手法を開発することができると、選抜される側の化合物のセットを色々と変えて試すことで、これまでに取得されたものとは異なる新しい化合物を取得できる可能性が広がります。また、これとは逆に、新たな細胞老化誘導剤の選抜手法を開発することができれば、さらに未知の細胞老化誘導剤が取得できることが期待されます。当研究室では、これまでに取得済みの細胞老化誘導剤の機能解析と並行して、自由な発想で新しい「選抜手法」を生み出したいと思っています。
細胞老化誘導剤を探すという研究には、細胞老化や個体老化の仕組みの理解につながるという期待だけではなく、がん細胞の増殖を抑制する薬剤の発見につながるという期待も含まれます。それは、細胞老化が持つ「不可逆的な細胞増殖停止」という性質を、がん細胞においても呼び起こすことが可能な場合があるからです。細胞老化誘導剤を取得するという戦略は、これまでにあまり例を見ません。また、細胞老化誘導を利用したがん治療法の開発は、細胞死の誘導を目指すこれまでのがん治療法開発に比べるとまだまだ認知度が低いです。したがって、このような戦略をさらに展開することにより、これまでのがん治療法に新たな手法を追加できたり、これまで「細胞死を誘導できなかったから」という理由で除外されてきたがん抑制方法の候補が、実は細胞老化を誘導することができると言うかたちで見直されたりすることが期待されます。