遺伝子改変マウスによる発症機構の解析
少年時代
私が生まれたのは京都であるが、父の仕事の関係で小学校に入学する前に愛媛の今治に引っ越し、そこで高校を卒業するまで過ごした。今治と言っても、私の住んでいたところは市の中心からはかなり離れた田舎であった。自然に恵まれたところで、海がすぐ近く、学校へは田んぼの中のあぜ道を通った。当時は、川の土手もコンクリートではなく、自然のままの部分が多く残されており、うなぎやナマズ、ふなやどじょうなどたくさんの魚がいた。学校の帰り道にはカラタチの生け垣があり、夏になるとアゲハチョウの幼虫がたくさん住みついていた。これを家に持ち帰り、やがて蛹となり、アゲハチョウが生まれて来るのを見るのがとても楽しみであった。また、家の軒下には雀が巣を作っており、巣から子を取ってきて自分で育てたことも何度かあった。餌を作るのがなかなか難しく、きな粉に小魚の骨などを混ぜたりして、色々工夫したことを覚えている。私がなぜ科学者として研究の道を選んだかを考えてみると、この頃の経験が大きく影響している様に思われる。実験すること、観察することが好きなのである。最近研究室に入ってくる院生を見ていると、以前に比べ実験が好きな人が減っているような気がする。私の子供の頃は幸いにも塾が広まる以前であり、仲間と一緒に自然の中でよく遊んだものであるが、最近は塾だけでなく、ゲームやテレビなど面白いものがあり過ぎて、自然に親しむ時間など、すっかりなくなってしまった。このような環境の中で育った若い人たちの中から、自然に興味を持ち、生物に興味を持つ者が出てくるのはなかなか難しいのではないかと、危惧している。
京都大学理学部時代
私は1966年に今治西高等学校を卒業した後、京都大学理学部に入学し、化学科に進学した。化学教室の学生実習は非常にユニークであった。まず最初にやったことは、上皿天秤の補正である。天秤の針が左右均等に振れているかどうかを調べ、丁度中央で振れる様に調整するのである。次に、この天秤を使って、摂氏24度の水1リットルの重さを量り、メスフラスコを補正し、次いで分銅を補正し、やっと実験が始まるのである。今ではさすがにこんな悠長なことはやってはいないと思うが、こうした教育のおかげで、原理原則にまで立ち返り、必ず自ら確かめる、という実験科学者として必要な基本的態度が身に付いたのではないか、と考えている。こうした教育を受けた所為か、私はキットを使うことを好まない。これまで、酵素反応を行ったり、細胞抽出液を作ったりする際は、必ず自ら反応液を調製し、一番効率の良いものを作り上げることが、腕の見せ所でもあった。ところが最近は多くの反応が既製のキットによって行われるようになった。 A液とB液を混ぜるだけで反応が進行する訳であるから、研究者にとってはこれほど便利なことはない。ただ、万一それでうまくいかないとお手上げである。A液の組成もB液の組成も知らないのであるから、工夫のしようがない。せいぜい別のメーカーのものを使ってみるだけである。私は、キットの氾濫が若い人から工夫したり考えたりする機会を奪っている様に思えて仕方がない。ただ、現実はキットを使う方が遥かに簡便、かつ、効率よく研究を進めることができるので、若い人はこれらのキットをふんだんに使うことのできるお金持ちのラボに行きたがることになる。一度、裕福なラボの出身者と貧乏なラボの出身者で、その後どちらがより良い仕事をしたかを調べてみたら面白いのではないか、と思っている。
大腸菌RNAポリメラーゼの研究
4回生となり、私は化学教室の生物化学研究室に籍を置く形で、実際はウイルス研究所の由良隆教授の研究室で大腸菌RNAポリメラーゼの研究を行うことになり、そのまま修士課程に進学した。突然変異体を作製し、その表現型を解析することによって遺伝子の機能を解明する、という明快な解析手法に惹かれた。修士課程から博士課程に進学するとき、丁度由良研から独立してウイルス研内に新しいラボを立ち上げることになった、石浜明先生のラボに移ることにした。私はRNAポリメラーゼの分子遺伝学に不満があった訳ではなかったが、遺伝学では間接的に推測するしか仕方なかったRNAポリメラーゼの構造を、実際に精製して直接調べることは別の魅力があった。この中で、私はRNAポリメラーゼのコア酵素に対する抗体を作製し、免疫沈降法によってポリメラーゼの量や共沈してくる蛋白質を解析することに初めて成功した。その結果、大腸菌のRNAポリメラーゼには複数のシグマ因子が存在することや、生体中のRNAポリメラーゼの数を決定することに成功した。今日抗体を使った共沈法は特定蛋白質に会合する蛋白質を同定する方法として広く用いられているが、当時としては他に例がなく、おそらく初めての試みではなかったかと考えている。この時測定した大腸菌1個の中のRNAポリメラーゼの数は、今でも教科書に引用されている(1)。また、大腸菌の増殖速度によってRNAポリメラーゼの数が変化することを見出し、RNAポリメラーゼの数によって大腸菌の増殖をシミュレートできることを示した。高等動物ではまだできていないが、将来的に、癌や関節リウマチといった疾病の発症過程まで計算機上に再現できれば、発症機構の理解や創薬に随分役立つはずであり、今後に残された重要な研究分野であると考えている。
インターフェロン (IFN) 研究から発生工学学研究へ
博士課程を修了するする少し前の1974年11月に、同じウイルス研の川出由己教授の研究室の助手となった。RNAポリメラーゼの研究は十分に面白かったが、発生や免疫などの高次の生命現象に対するあこがれのようなものがあった。川出研では当時、マウスL細胞から産生されるIFNがウイルス増殖だけでなく、細胞増殖も抑制するかどうかが問題となっていた。当時新しく大学院に入ってきた米原伸君(現京大教授)と一緒に、抗体を使ったアフィニティーカラムを導入することによって、IFN分子をほぼ完全に精製し、IFNが抗ウイルス活性だけでなく、細胞増殖抑制活性も持つことを初めて証明した(2)。現在では1つのサイトカインが複数の生物活性を持つことは常識であるが、当時は驚きであった。
私が川出研の助手となって間もない頃、Mintz とIllumenseeにより、腹水癌として8年間も経代された悪性奇形腫から正常な個体を再生できることが報告された(3)。この報告は衝撃であった。培養細胞から一個の個体が再生されただけでなく、癌細胞でも正常な環境の中に置かれれば正常な個体を作ることができる、というのだから驚き以外の何者でもなかった。私は、どうしても奇形腫の分化メカニズムが知りたく、川出先生を説得し、当時理学部の動物学教室におられた野口先生(静岡大理学部の野口基子教授のご主人)から奇形腫を入手した。川出先生と二人でマウスの世話をしながら、腹水で奇形腫を経代したのを覚えている。しかし、Mintzらの実験結果は追試できないということが現在は分かっている。その意味では誤った情報によって発生学を始めたことになるが、意外にもMintzらが奇形腫を用いて示した様に事態は展開する。1981年には、Evans, Kaufman, Martinらによってembryonic stem cell(ES細胞)が樹立され、これらの細胞を使えばMintzらが示した様に、ES細胞が由来した元の個体を再生できることが示されたのである。Mintzらの使った奇形腫細胞の中に未分化の幹細胞が紛れ込んでいたのだろうか、事実は今もって謎である。とにかく、彼女達の論文によって、多くの研究者が何とか追試を試みようとして、ES細胞が生まれてきた、と言って良いだろう。その後、Capecchi, Smithiesらによる相同組換え法の開発により、遺伝子欠損マウスの作製が可能となる。一方、トランスジェニック (Tg) マウスの方は、遺伝子欠損マウスより少し早く、1980年にGordonらによって報告された。
1980年にウイルス研に戻った私は、1982年に発表されたPalmiterらのラットの増殖因子遺伝子を組み込んだジャイアントマウスの報告に強く刺激され(4)、自分もTg マウスを作製することを決意する。大腸菌の分子遺伝学から研究を始めた私にとって、突然変異体の作製は言わば研究の入り口であり、変異体がないことには研究が始まらない、といっても過言ではなかった。ところが、マウスでは人為的に変異体を作るすべがなく、当時はBennett先生の様に自然突然変異体を集めるしか仕方がなかったが、なかなか自分が必要なものは手に入らなかった。胚に遺伝子を導入して発生させ、個体レベルでその遺伝子の機能を調べる、というやり方は、とても斬新で、大きく発展することが予感できた。手探りでTgマウスの作製を始め、3年後には何とかβ型IFN遺伝子を導入したTgマウスの作製に成功した(5)。丁度その頃、東京大学の医科学研究所でパラミキソウイルスの研究をしておられた渋田博先生から医科研に来ないか、というお誘いがあり、1985年に東大に移ることにした。ウイルス学の分野ではほとんど何の実績も持たなかった私に声をかけて頂いたのは、渋田先生自身がこの新しい技術の可能性を信じておられたからだと思っている。渋田研ではHTLV-I TgマウスとHIV-1 Tgマウスを作製した。
発生工学手法を用いた関節リウマチに関する研究
ウイルス研の日沼頼夫先生が成人T細胞白血病ウイルス(HTLV-I)を発見されたのは1982年である。日沼先生は気さくなお人柄で時々私の部屋に来られて、その新しいウイルスについて話をして下さった。私はこのウイルスに興味を持ち、畑中正一先生からウイルス遺伝子を頂き、Tgマウスを作ることによって白血病のモデルができないかを試すことにした。当時、ウイルス学分野でまだそのような試みはなかった。ところがこれらのマウスはいつまで待っても一向に白血病を発症してくれなかった。しかし、偶然にもある日これらのマウスの足首関節が腫れていることに気がつき、調べてみると、これらのマウスは自己免疫となっており、関節炎の病理像は人の関節リウマチに非常に良く似ていた。この結果は、このウイルスが人でも関節リウマチを引き起こしている可能性を示唆するものであり、我々はこの結果をScience誌に報告した (6)。その後、このウイルスが関節リウマチの発症に関与していることは疫学的にも証明されており(7)、発生工学的手法で作製した疾患モデルによって病因の一つが突き止められた最初の例になるのではないか、と考えている。
我々はHTLV-I Tgマウスの関節炎局所で炎症性サイトカインの発現が亢進していることを見出し、これらのサイトカインが病態形成で重要な役割を果たしているのではないか、と考えた。そこで、これらのサイトカイン欠損マウスを作製し、その役割を検討することにした。まず、IL-1レセプターアンタゴニスト(IL-1Ra)欠損マウスを作製し、これが自己免疫性の関節炎を自然発症することを見出し、過剰なIL-1シグナルが自己免疫を誘導することを示した(図1)(8)。また、IL-1α、IL-1β、IL-1α/β欠損マウス(浅野雅秀:現金沢大学、宝来玲子:現NIHら)(9)、およびIL-17A、IL-17F、IL-17A/F欠損マウス(中江進:現東大医科研、石亀晴道:現Yale大)(10, 11)を初めて作製すると共に、TNFα欠損マウス(関川賢二)、IL-6欠損マウス(Manfred Kopf)を入手し、これらのサイトカイン欠損が関節炎発症に及ぼす影響を検討した。この結果、IL-1α/β、およびIL-17Aの欠損はHTLV-I Tgマウス、及びIL-1Ra欠損マウスの関節炎発症を強く抑制するのに対し、TNF-αはIL-1Ra欠損マウスの発症に関与しており、一方IL-6はHTLV-I Tgマウスの発症に関与していることを示した(12, 13)。IL-1、TNF-α、IL-6はいずれも人の関節リウマチの発症でも重要な役割を果たしていることが認められており、これらのサイトカインに対する抗体や阻害蛋白質が治療薬として次々と開発されている。これらのサイトカインの機能が解明される今から10年ぐらい前の時点では、関節リウマチに対する有効な治療法はなく、関節炎の進行を食い止めることは難しかったのであるが、最近では早期に治療を始めれば寛解に持ち込むことも可能になってきた。一つの謎は、マウスの関節リウマチモデルではIL-17Aが関節炎発症に於いて中心的な役割を果たしていると考えられるのに対し、関節リウマチ患者ではTNF-αやIL-6ほど重要な役割は担っていない様に見えることである。マウスモデルの限界、と言ってしまえばそれまでであるが、何か重要な理由が隠されているようで、非常に興味を持っている。ちなみに、IL-17Aに対する抗体は、乾癬の治療に対して著功を発揮することが分かっている。この様に、関節リウマチや乾癬などの自己免疫疾患は、基礎研究の成果を治療に結び付けることにうまく成功した領域の一つであり、遺伝子改変マウスを用いた研究がこの流れの中で大きな役割を果たした事を考えると、一人の研究者としてこの中に参加できたことを誇らしく、かつ、幸せに思っている。

自然免疫受容体、及び腸管免疫
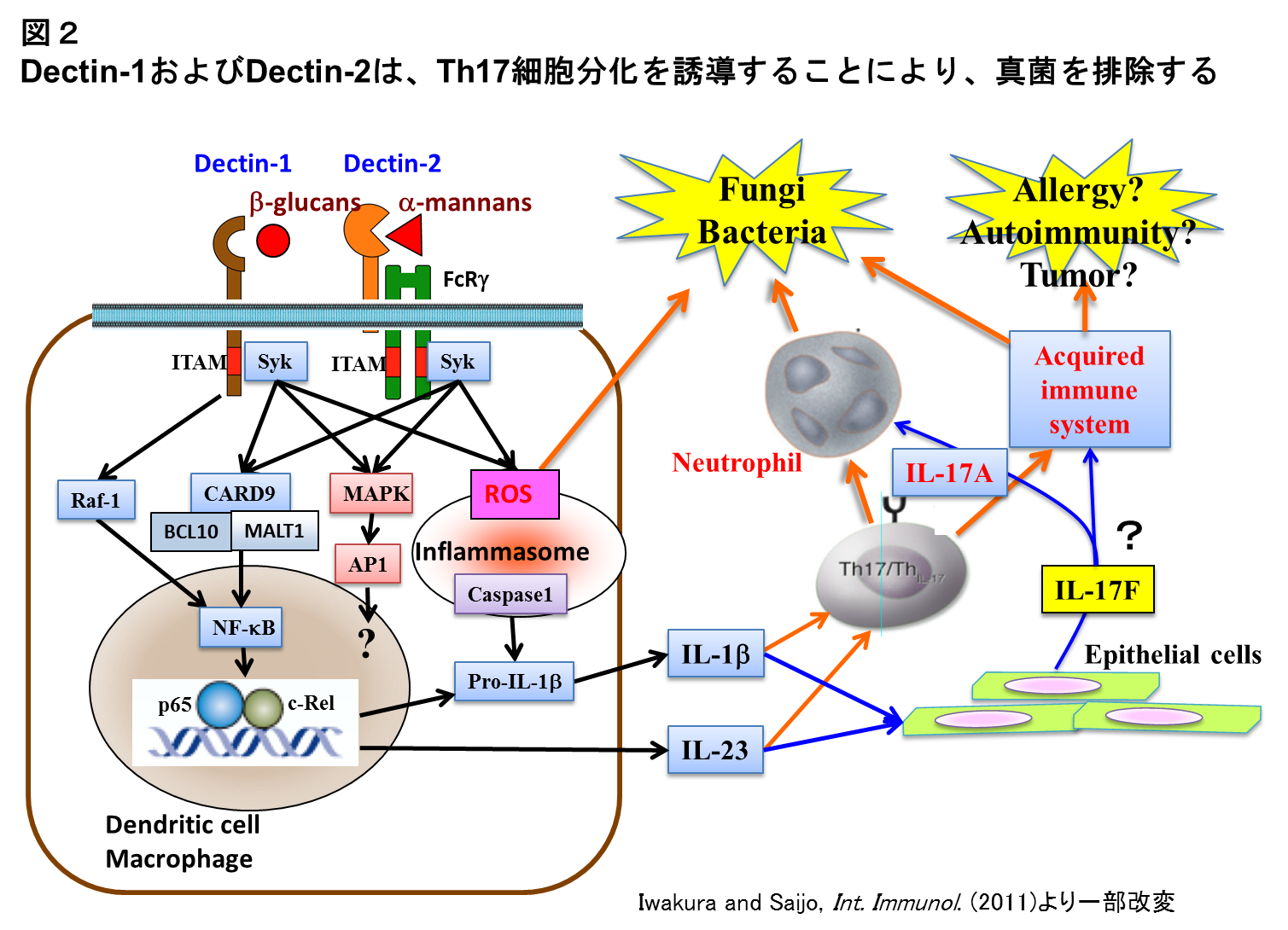
関節炎モデルマウスの関節では、炎症性サイトカインの他にDCIRやDectin-1などのC型受容体と呼ばれる一群の遺伝子の発現が亢進していることが分かった。興味深いことに、これらの遺伝子と人の関節リウマチや多発性硬化症などの自己免疫疾患との連鎖が認められた。そこで、これらの遺伝子の役割を知るために遺伝子欠損マウスを作製したところ、DCIR欠損マウスでは自己免疫性の付着部炎や唾液腺炎が自然発症することが分かり、この分子が樹状細胞の増殖制御を介して免疫系の制御に重要な役割を果たしていることがわかった(14)。現在、この分子は骨代謝でも重要な役割を果たしていることが分かっており、自己免疫疾患や骨代謝疾患の治療標的になるものと考えている。一方、Dectin-1, Dectin-2は、それぞれ真菌の細胞壁の構成成分であるβグルカン、およびαマンナンの受容体であることが分かり、いずれも真菌の感染防御で重要な役割を果たしていることを示した(15, 16)。興味深いことには、これらの受容体からのシグナルによってIL-6やIL-23のようなサイトカインが作られ、その結果Th17細胞が優先的に分化誘導され、IL-17AやIL-17Fが分泌されることによって真菌が排除されることが分かったことである(図2)(16)。真菌感染によって誘導されてくるTh17細胞は自己免疫やアレルギーを引き起こすことはないのか、興味深い問題である。
最近、腸管の細菌叢は免疫系に重大な影響を与えることが分かってきた。例えば、SFBと呼ばれる細菌はTh17細胞を特異的に誘導し、実験的自己免疫性脳脊髄炎(EAE)の発症に影響を及ぼしたり、クロストリジウム属の細菌のうちいくつかのものはTreg分化を誘導したりすることが分かっている。一方、我々はIL-17AおよびIL-17Fが腸管の細菌感染防御に重要な役割を果たすことを明らかにした(11)。また、昨年はDectin-1が腸管の常在性の真菌叢制御に重要な役割を果たしていることも報告されている。必然的にIL-17AやF、Dectin-1、2などは腸管の細菌や真菌の構成に影響を与えることが予想され、その結果、感染症だけでなく、自己免疫やアレルギー、発癌などに関与している可能性が考えられる。これらのシグナルが何によって活性化され、どのようにしてサイトカインが誘導されるのか、現在まだ良く分かっていないが、食品成分や腸内細菌が重要な役割を果たしていることは間違いない。196070年代にはほとんど見られなかった、花粉症や炎症性大腸炎のような疾患が最近非常に増えているのは、もしかすると我々が気づかない、何かの環境因子や食品成分によって引き起こされている可能性はないのか、最近気になっている。2012年、東京大学から東京理科大学に移ったのを機に、食物や常在細菌など環境が我々の免疫システムに与える影響について解析してみたいと考えている。
遺伝子改変マウスを用いた研究の今後
これまで相同遺伝子組換え法を用いた遺伝子欠損マウスの作製は、特殊な技術と長い時間が必要であったため、一般のラボではなかなかこうしたマウスを作製することが難しかった。このため、各大学、研究施設では共通のコアファシリティーを整備することによって、各研究者がこれらのマウスを利用できる様に努力を重ねてきた。また、文部科学省の支援によって、東大、熊大、阪大を核に、全国的に遺伝子改変マウスの作製を支援する組織も作られている。国際的にも、International Knockout Mouse ConsortiumやInternational Mouse Phenotyping Consortiumなどの組織によって変異ES細胞ライブラリーが整備され、必要な変異ES細胞が比較的容易に手に入る様になった。今後はES細胞だけでなく、変異マウスそのもののライブラリーも整備されようとしており、今後益々遺伝子改変マウスを用いた研究が加速されることが予想される。
このような動きとは別に、ES細胞を用いないで、直接胚の特定遺伝子に変異を導入する方法の開発が最近盛んに行われている。ZFNと呼ばれるZinc Finger ヌクレアーゼを利用したもの、あるいは、TALENと呼ばれる植物に感染するバクテリア由来のヌクレアーゼを利用したものがある。更に今年になって、新たにCRISPR-Casシステムによって、直接受精卵の遺伝子に突然変異を導入できることが報告された(17)。この方法は細菌が自己防衛機構として持つ外来ゲノム排除機構を利用したもので、これまでより簡便で速く、しかも遥かに効率が良いことから、今後相同遺伝子組み換え法に取って代わることが予想される。この方法を用いれば、もはや遺伝子改変ES細胞のライブラリーすら必要なく、その都度必要に応じて直接遺伝子改変動物を作製する時代が来るのではないか、とさえ言われている。
1980年に初めてTgマウスが報告されて以来、遺伝子改変マウスは生物学・医学研究に多大の貢献をしてきた。今後もしばらくは、遺伝子改変マウスを用いて遺伝子機能の解析が進められることは間違いない。こうして得られた情報が我々の健康を増進させ、疾病を克服するために貴重な知識となることを確信している。ただ、遺伝子の数が3万に満たず、そのうち5000遺伝子程度の機能は既に明らかにされていて、しかも誰もが簡単に遺伝子改変マウスを作製できる様になると、残りの遺伝子の機能が明らかになる日はさほど遠くないであろう。その時、生物学者は一つのゴールに到達することになる。しかし、全ての遺伝子の配列が明らかとなり、その機能が分かった時、それで生命を理解したことになるのであろうか。生命という複数の遺伝子によって構成される生体システムの営みが、単にシステムを構成する各遺伝子の制御機構を解明することによって理解できるのか、という問いは興味深い問題である。発生学や免疫学に個別の遺伝子の機能を解明しても理解できないような問題が残されているのか、真剣に考えてみる必要がある。
参考論文
1. Iwakura, Y., Ito, K., and Ishihama, A. Biosynthesis of RNA polymerase in Escherichia coli. I. Control of RNA polymerase content at various growth rates. Molec. Gen. Genet., 133, 1-23 (1974).
2. Iwakura, Y., Yonehara, S., and Kawade, Y. Purification of mouse L cell interferon: Essentially pure preparations with associated cell growth inhibitory activity. J. Biol. Chem., 253, 5074-5079 (1978).
3. Mintz, B., and Illumensee, K. Normal genetically mosaic mice produced from malignant teratocarcinoma cells. Proc. Natl. Acad. Sci. USA, 72, 3585-3589 (1975).
4. Palmiter, R. D., Brinster, R. L., Hammer, R. E. et al. Dramatic growth of mice that develop from eggs microinjected with metallotionein-growth hormone fusion genes. Nature, 300, 611-615 (1982).
5. Iwakura, Y., Asano, M., Nishimune, Y., and Kawade, Y. Male sterility of transgenic mice carrying exogenous mouse interferon-γ gene under the control of the metallothionein enhancer-promoter. EMBO J., 7, 3757-3762 (1988).
6. Iwakura, Y., Tosu, M., Yoshida, E. et al. Induction of inflammatory arthropathy resembling rheumatoid arthritis in mice transgenic for HTLV-I. Science, 253, 1026-1028 (1991).
7. Yamano Y. and Nishioka, K. The contribution of Asian researchers to the field of rheumatology. Nat. Rev. Rheumatol., 6, 106-111, 2010,
8. Horai, R., Saijo, S., Tanioka, H. et al. Development of chronic inflammatory arthropathy resembling rheumatoid arthritis in IL-1 receptor antagonist-deficient mice. J. Exp. Med., 191, 313-320 (2000).
9. Horai, R., Asano, M., Sudo, K. et al. Production of mice deficient in genes for IL-1α, IL-1β, IL-1α/β, and IL-1 receptor antagonist shows that IL-1β is crucial in turpentine-induced fever development and glucocorticoid secretion. J. Exp. Med., 187, 1463-1475 (1998).
10. Nakae, S., Komiyama, Y., Nambu, A. et al. Antigen-specific T cell sensitization is impaired in IL-17-deficient mice, resulting in the suppression of allergic cellular and humoral responses. Immunity, 17, 375-387 (2002).
11. Ishigame, H., Kakuta, S., Nagai, T. et al. Differential roles of IL-17A and IL-17F in host defense against mucoepithelial bacterial infection and allergic responses. Immunity, 30, 108-119 (2009).
12. Iwakura, Y. Roles of IL-1 in the development of rheumatoid arthritis: Consideration from mouse models. Cytokine Growth Factor Rev., 13, 341-355 (2002).
13. Nakae, S., Saijo, S., Horai, R. et al. IL-17 production from activated T cells is required for the spontaneous development of destructive arthritis in mice deficient in IL-1 receptor antagonist. Proc. Natl. Acad. Sci. USA, 100, 5986-5990 (2003).
14. Fujikado, N., Saijo, S., Yonezawa, T. et al. Dcir deficiency causes development of autoimmune diseases in mice due to excess expansion of dendritic cells. Nature Med., 14, 176-180 (2008).
15. Saijo, S., Fujikado, N., Furuta, T. et al. Dectin-1 is required for host defense against Pneumocystis carinii but not against Candida albicans. Nature Immunol., 8, 39-46 (2007).
16. Saijo, S., Ikeda, S., Yamabe, K. et al. Dectin-2 recognition of &α-mannans and induction of Th17 differentiation is essential for host defense against Candida albicans. Immunity, 32, 681-691 (2010).
17. Cong, L., Ran, F. A., Cox, D. et al. Multiplex genome engineering using CRISPR/Cas system. Science, 339, 819-823 (2013).
