ヒトレトロウイルス感染症モデル:エイズモデル
I.背景
レトロウイルスが動物に癌を起こすことは以前から知られていたが、ヒトT細胞白血病ウイルス(HTLV)はヒトに癌(成人T細胞白血病:ATL)を引き起こすレトロウイルスとして初めて同定された(1)。その後HIVがエイズの原因ウイルスであることが明らかにされ、レトロウイルスはヒトの病因ウイルスとしても重要であることが示された(2)。この他にも自己免疫病や神経症にレトロウイルスの関与が疑われているものがあるが、現在のところはっきりしない。
HIVとHTLVに共通していることは、宿主域が狭くサルの他にはよい感染系がないことである。このことは、ワクチンや治療薬を開発するうえで大きな障害となっている。そこで我々はこれらのウイルス遺伝子を導入したトランスジェニック(Tg)マウスを作製することにより宿主域バリヤーを越え、病態モデルを作ることを試みた。
レトロウイルスによる感染症のモデルとしてTgマウスを使うことには利点と同時に限界があることを指摘しておく必要がある。利点としては、サルを使う場合に較べ、遺伝学的、微生物学的制御が容易であること、動物の取り扱いが容易であること、経済的であること、動物愛護上の問題がより少ないことなどがあげられる。しかもレトロウイルスは自然感染の場合にもウイルス遺伝子は宿主DNAに組み込まれた状態で遺伝子発現を行うことから、遺伝子発現の調節機構が自然感染時に近いことが特徴である。一方、Tgモデルは垂直感染様式をとることから、通常の水平感染の場合とは異なる臓器に障害が発生したり、ウイルスに対する免疫応答が見られない場合がある。また、ウイルスレセプターがないために再感染が起こらず、感染の拡大を見ることができないなどの問題点がある。従って、Tgマウスを疾患モデルとして用いる場合には、実際の病気と比較して病態の異同をよく吟味し、モデルとしての有用性を検討することが重要である。
我々は、HIVおよびHTLV遺伝子を導入したTgマウスを作製し、HIV-Tgはヒトの健常キャリヤーのモデルとして、HTLV遺伝子導入マウスは関節リウマチによく似た慢性関節炎のモデルとして有用であることがわかった。本稿ではHIV-Tgについて紹介する。なお、HTLV-Iについては別の紹介記事(関節リウマチの発症機構:疾患モデルからの考察)があるので、参照されたい。
II.エイズ
エイズはHIV感染により、CD4陽性(ヘルパーT)細胞の減少あるいは機能不全が引き起こされ、その結果免疫力が低下し、種々の日和見感染によって死に至る病気である。エイズ患者に見られるkaposi肉腫やエイズ脳症にもHIVが直接関与すると考えられている。
HIVはレトロウイルス科のレンチウイルス亜科に属するウイルスで、プラス鎖RNAを遺伝子として持つ(2)。感染後、逆転写酵素により2本鎖DNAに変換され、宿主染色体に組み込まれ、遺伝子発現を行う。遺伝子の両端にはLTRと呼ばれる制御領域があり、構造遺伝子としては、gag、pol、envなどをコードしている(図1)。またこのウイルスは、tatやnef、rev、vprなど多くの制御遺伝子をコードしていることが特徴で、自身の複製を制御するだけでなく、宿主にも複雑な影響を及ぼす。ウイルスのレセプターとしては、CD4分子と同時にCCR5やCXCR4などのケモカインレセプターが共同して機能することが知られている。マウスのCD4分子はヒトのものと異なっており、HIVレセプターとして機能しない。それだけでなく、マウスとヒトでは転写因子などにも種間差があり、このため、HIVはマウスでは増殖できないことがわかっている。
エイズはHIVに感染してから通常5ー10年にもおよぶ長い潜伏期を経て発症する。最初感染した直後には血中に大量のウイルスが検出されるが、やがて液性免疫、細胞性免疫が成立して血中からはウイルスがほとんど消失する。しかしこの時点でもリンパ節ではウイルスの産生が持続していることが知られており、通常の意味での潜伏感染ではない。この間、ウイルスはいくつかの突然変異を起こすことにより、免疫を逃れると共により強い毒性を獲得する。一方ウイルスの増殖によってCD4陽性T細胞が破壊されるために、徐々にT細胞が減少し免疫機能が低下する。やがて免疫とウイルスとの均衡が破れると急激に血中ウイルス量が増加し、発症に至る。この過程において、CD4陽性細胞の減少とともに、CD8陽性細胞の機能不全が最近注目されており、CD8細胞が出す何らかのウイルス抑制因子が分泌されなくなる可能性や、Th1タイプからTh2タイプへのスイッチが抗ウイルス活性に中心的な役割を果たしている細胞性免疫の低下に関与していることが考えられている。また、症状の悪化とウイルス量はよく対応することがわかっており、ウイルス遺伝子の活性化は症状の進行に基本的に大きな役割を果たしていると考えられる。
1995年、David Ho達はエイズ患者のなかでは一見CD4陽性T細胞の数が安定しているように見える時期でも、実はウイルスが激しく増殖しており、このため半減期2日程度というきわめて激しいT細胞のturnoverが起こっていることを示すと共に、 HIVの変異頻度が極めて高く、単一の抗HIV薬ではすぐに耐性変異ウイルスができてくることを示した(3)。この結果、エイズの発症を阻止するにはウイルスの増殖を抑制することが有効であり、しかも、単剤ではなく、多剤を同時に投与することによって耐性ウイルスの出現を予防できることがわかった。こうした知見に基づき、多剤による治療(HAART治療)が行われるようなった結果、現在ではエイズの発症をかなりコントロールできるようになってきた。しかし、残念なことにこの治療法では感染細胞を完全に駆逐することはできず、治療を中断すると再びウイルスが増殖し始めることが知られており、より根本的な治療法の開発が望まれている。
III.HIV遺伝子導入Tgマウスの作製
HIV-IのDNAクローンNL4.3.2から逆転写酵素遺伝子部分を欠失させたもの(図1)をC3H/HeNマウスの受精卵にマイクロインジェクトする事により作製した [C3H/HeN-TgN(HIV-Δpol)1607Jms](4)。
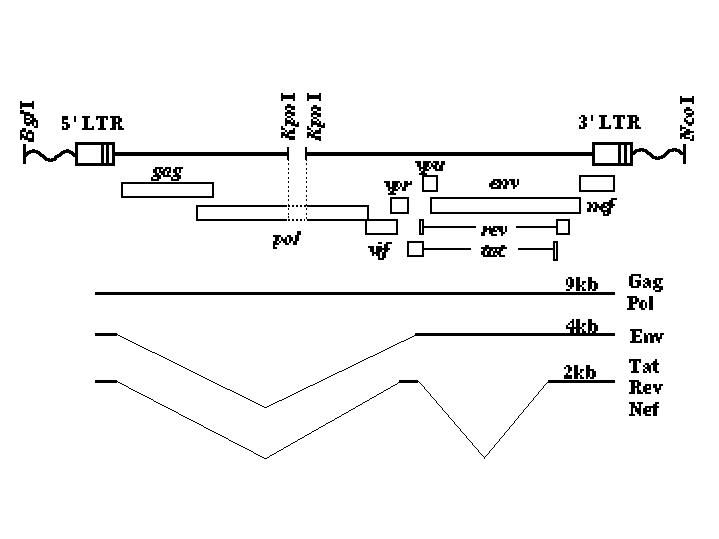
図1.導入遺伝子の構造とmRNA
HIV-1遺伝子(NL4.3.2)の逆転写酵素遺伝子(Kpn I-Kpn I領域)を欠損させたものを導入した。
IV.HIV-1遺伝子導入Tgマウスの特徴
導入遺伝子は1番染色体の長腕の一カ所に約10コピーが挿入されていた。これらのマウスは3カ月齢頃から白内障を発症し始め、12カ月齢頃までには全てのマウスが発症した(4)。末梢血中のCD4+/CD8+細胞比が10-40%低下していたが、卵白アルブミンに対する免疫応答能は正常であった。導入遺伝子の発現は眼のレンズ細胞、筋肉などで強く見られ、皮膚や脳、脾臓、胸腺などでも発現が認められた。メッセンジャーRNAはヒト感染細胞でみられるものと同じく、9kb、4kb、2kbの3種が認められた。ウイルス構成蛋白質も正常に合成されており、血中には正常な浮遊密度を持つウイルス粒子が認められた(5)。
眼のレンズ細胞の中には大量のp24Gag蛋白質の蓄積が認められたことから、このことが白内障の原因であると考えられた。通常エイズ患者に白内障が認められることはなく、Tgマウスで全身の細胞に遺伝子が組み込まれたためにみられる現象である。遺伝子が全身の細胞に分布しているにも拘わらず組織特異的な遺伝子発現が見られたことは、HIV感染の組織特異性がレセプターだけではなく、細胞内の転写装置によってもコントロールされていることを示している。ことにkaposi肉腫やエイズ脳症の発生部位である皮膚や脳で遺伝子発現が強く認められたことは興味深い。
リンパ組織に於ける導入遺伝子の発現は生理状態では非常に低かったが、細菌のリポ多糖(LPS)やスーパー抗原(SEB:Staphylococcus Enterotoxin B)を投与すると2-3日後に発現が30-40倍促進されることが分かった(図2)(5)。LPS投与時には血中に非感染性ウイルス粒子が認められ、p24Gag蛋白質の血中濃度はエイズ患者の血中濃度に匹敵する、400pg/mlにも達した。この時、血中にはTNF-αやIL-1、IL-6などの炎症性サイトカインが高レベル検出された(図3)。そこで、これらのサイトカインがウイルス産生に及ぼす影響を検討するために、サイトカイン欠損マウスとの掛け合わせを行った。その結果、TNF-α、あるいはIL-1α/βを欠損させると強くHIV遺伝子発現、及び粒子産生が抑制されることがわかった(図4)(5)。一方、IL-1α、あるいはIL-1β単独、IL-6、IFN-γなどの欠損は遺伝子発現に影響を与えないことがわかった。この結果、HIV遺伝子発現にはTNF-α、およびIL-1が重要な役割を果たしていることがわかった。
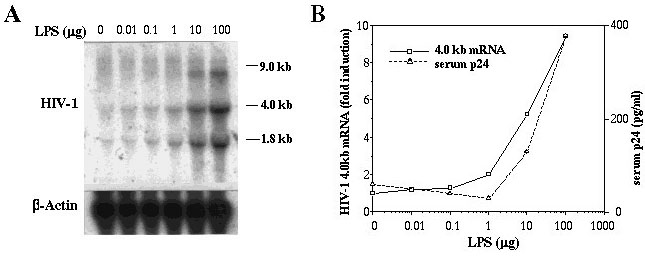
図2.HIV遺伝子のLPSによる発現誘導
HIV-TgにLPSを腹腔内投与したところ、用量依存的にHIV遺伝子の発現誘導がみられた。A.脾臓RNAのノザンハイブリダイゼーション、B.脾臓中のHIV特異的mRNA量と血中p24Gag蛋白質量。
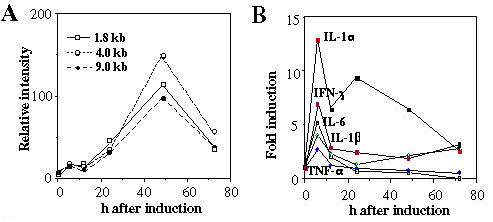
図3.LPS投与後のHIVmRNAの誘導とサイトカインの発現
HIV-Tgに100mgのLPSを投与し、HIVmRNAの発現(A)、およびサイトカインの発現(B)を経時的に測定した。
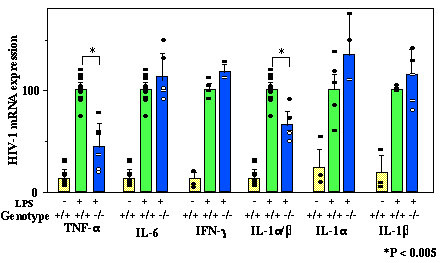
図4.遺伝子欠損マウスにおけるHIVmRNA の誘導
それぞれのサイトカイン欠損HIV-TgマウスにLPSを投与し、HIVmRNAの発現を検討した。TNF-α、およびIL-1α/β欠損マウスでは発現量が低下していた。
V.HIV-Tgの疾患モデルとしての有用性
以上述べた様に、HIV-Tgマウスにおいてもヒト感染細胞と同じく正常なmRNA合成が起こり、かつ、そのmRNAから正常なウイルス粒子蛋白質が作られることがわかった。しかしながら、逆転写酵素を欠損させているため、当然のこととしてこれらの粒子に感染性は認められなかった(5)。このマウスでは通常リンパ組織における遺伝子発現のレベルは低く、LPSなどで活性化することによって、強く発現が誘導される。従って、このTgマウスはヒトの健常感染者のモデルと考えることができる。以下の様な利用が考えられる。
1)抗HIV薬のスクリーニング。
これまで、小動物を使ったスクリーニング系はなく、本Tgモデルは極めて貴重である。細胞レベルだけでは毒性や代謝の問題があるため、動物個体を使った検討が必要であり、サルなどを使って行う検討の前段階として有用である。
2)HIV遺伝子の活性化のメカニズムの解析。
動物個体を使ってHIVの活性化がみられる系は霊長類の他にはない。特に、マウスの場合、遺伝背景、微生物汚染を厳密に制御できるほか、他のトランスジェニックマウスやノックアウトマウスと掛け合わせるなどの、サルではできないアプローチが可能である。
3)HIVの病原性の検討。
高レベルのウイルス産生がみられることから、宿主に対する毒性を検討するために有用である。実際、これらのマウスは生理状態でCD4陽性細胞が10?40%減少しており、感染患者と同じ様なことが起きているものと考えられる。従って、これらのマウスを使うことにより、T細胞減少のメカニズムの解析や、感染T細胞動態の解析、さらには感染T細胞排除法の検討など、多くの課題を検討することができるものと考えている。
ところで、本モデルの遺伝子発現量は感染ヒト細胞に較べ、数10分の1程度しかない。これは転写因子の一つである、Cyclin T1がヒトとマウスで異なっているためである可能性が考えられた。そこで、Cyclin T1遺伝子を導入したTgマウスを作製したところ、ウイルスの発現量が100~1000倍も亢進することがわかった(6)。このダブルTgマウスを用いることにより、より詳細な病原性の解析が可能になるものと期待している。
文献
1. Sugamura, K., and Hinuma, Y.: Human retroviruses:HTLV-I and HTLV-II. In"The Retroviridae", vol. 2, ed. J. A. Levy, Plenum Press, New York, 1993, 399-435.
2. Levy, J. A.: Pathogenesis of human immunodeficiency virus infection. Microbiol. Reviews 1993, 57:183-289.
3.Ho, D. D., Neumann, A. U., Perelson, A. S. et al.: Rapid turnover of plasma virions and CD4 lymphocytes in HIV-1 infection. Nature 1995, 373:123-126.
4. Iwakura, Y., Shioda, T., Tosu, M., et al.: Human immunodeficiency virus type 1 induces cataract in transgenic mice. AIDS, 1992, 6:1069-1075.
5. Tanaka, J., Ozaki, H., Yasuda, J., et al.: Lipopolysaccharide-induced HIV-I expression in transgenic mice is mediated by tumor necrosis factor-a and interleukin-1, but not by interferon-g nor interleukin-6. AIDS, 2000, 14:1299-1307.
6.安田二朗、田中純、岩倉洋一郎、第48回日本ウイルス学会抄録集、2000、p.259。
