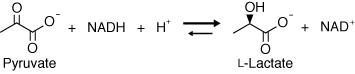【背景〜未知の糖鎖と酵素の探索への課題〜】(open)
糖鎖は分解されてエネルギー源となるだけでなく、エネルギーの貯蔵物質、細胞骨格、感染やそれに対する防御応答といった生物間の相互作用など多様で重要な役割を担っています。それは、糖鎖が膨大な種類の化学構造を取りうるからと言えるでしょう。その数は単糖が6個の糖鎖でさえ計算上は1兆を超えるとされるほどです。その糖鎖はおおよそ酵素によって合成・分解されるため、この酵素群(糖質関連酵素群、*1)も複雑な進化により、その機能と構造も多種多様になっています。私たちが知らない酵素はまだ多くあると考えられます。
糖鎖に作用する酵素を研究するうえで問題となるのは基質の入手です。自然界に豊富ある糖鎖であれば入手は容易ですが、糖鎖構造は多種多様であり、希少ではあるものの生物にとって重要な役割を果たす糖鎖は多数存在します。そのため、そのような希少な糖鎖の合成や分解を行う酵素を探索することは難しい場合が多いのです。
【β-1,2-グルカン関連酵素〜ユニークな糖鎖に作用する酵素〜】
当研究室では
β-1,2-グルカンというおそらく聞いたことがない珍しい糖鎖を材料としています。しかし、これもグルコースからできている糖鎖であり、その点はデンプンや植物細胞壁の主要成分であるセルロースと同じです。生物における最も主要な糖が鎖状になったものでさえよく知らないものがある、これは糖鎖の奥深さを表していると考えています。
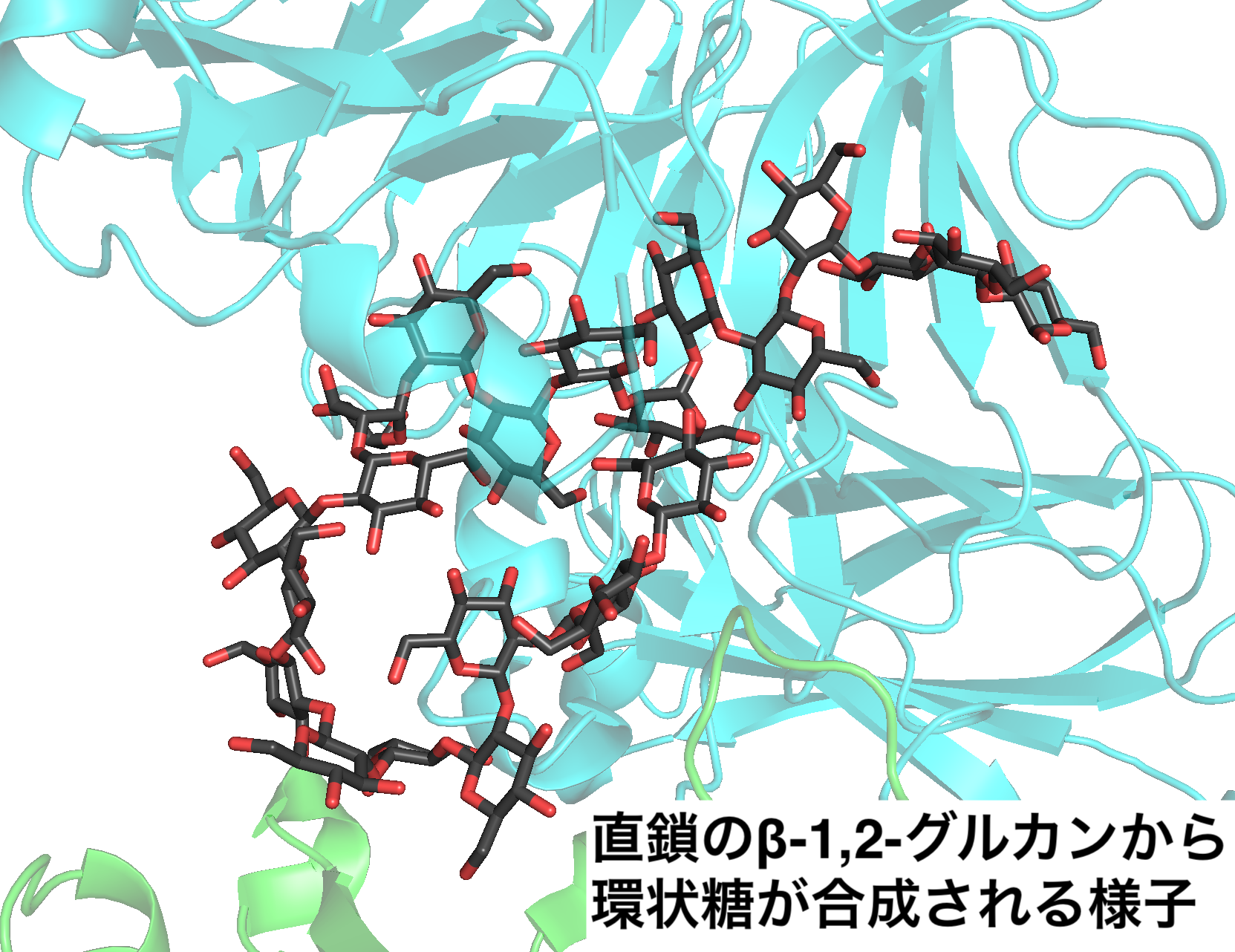
私たちは、β-1,2-グルカンの合成が可能な酵素の発見を端緒にβ-1,2-グルカンの大量合成法を確立したことで、β-1,2-グルカン関連酵素群の探索を現在中心的に行っています。実際に、様々な新規のβ-1,2-グルカン関連酵素の発見を報告しており(
主な成果のリスト)、2024年には
植物病原菌の生産する病原性因子とされる糖鎖の合成酵素を同定したことが、化学系のトップジャーナルの一つである
JACSに掲載されました(
論文、
概要)。2026年1月時点で、β-1,2-グルカン関連酵素の研究をできているのはここだけだと思われます。また、ここからβ-1,2-グルカンとは異なる新たな糖鎖に作用する新たな酵素群の探索へも展開しつつあります。そういった意味で、当研究室は
非常にオリジナル性の高い研究領域を持っているといえるでしょう。また、私たちの研究室では、
X線結晶構造解析もメインの技術として取り扱っています。自分たちで発見した酵素について自分で構造解析まで行い、酵素がはたらく分子メカニズムを明らかにするというのはとても楽しいです。
乳酸脱水素酵素とは?
乳酸脱水素酵素 ( LDH ) は NAD(H) を用いてピルビン酸と乳酸との間の酸化還元反応を触媒する酵素の総称であり、原核生物から真核生物にいたるまで、幅広く存在して嫌気的解糖や乳酸発酵において重要な役割を果たしている。生成物である乳酸には鏡像異性体が存在するが、LDH
はこれらのうちでどちらか一方しか生成しない。そのため、生成物の違いによってL型乳酸脱水素酵素 ( L-LDH : EC 1.1.1.27 )、D型乳酸脱水酵素 ( D-LDH : EC1.1.1.28 ) に大別されている。両者は類似した反応を触媒するため、かつては相同的な酵素であると考えられていたが、本研究室の構造解析および系統解析の結果から、両者は全く異なる酵素であることが明らかになった。前者は
L-リンゴ酸脱水素酵素とともに L-2-ヒドロキシ酸脱水素酵素ファミリーを構成しており、1980 年代前半までに、主に脊椎動物の酵素で構造解析や機能解析が盛んに行われ、数多くの知見が得られている。一方、後者は多くの基質特異性が異なる
D-2-ヒドロキシ酸脱水素酵素群やギ酸脱水素酵素 ( FDH ) などとともに D-2-ヒドロキシ酸脱水素酵素ファミリーを構成しており、これまでに数多くの知見が得られている。本研究室では L-LDH、 D-LDH 両方の研究を行っている。
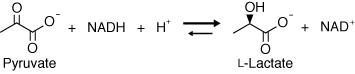
図1 L-LDHの触媒反応
アロステリック効果
アロステリック効果とは何らかの因子が酵素の活性部位以外の部位に結合することで触媒活性が変化する現象のことで、L-LDH にもアロステリック型酵素が細菌に広く分布している。細菌のもつアロステリック型 L-LDH は、一般にピルビン酸等の基質による活性化
( ホモトロピックな調節 ) と、解糖系の中間代謝産物である Fructose 1,6-bisphosphate ( FBP ) による活性化(ヘテロトロピックな調節)を受けるが、それ以外にも Mn2+イオン等も調節に関わる酵素があり、生物種によってその調節様式に多様性が見られる。
細菌では、近縁株同士の L-LDH であってもアロステリック特性が異なることがある。例えば乳酸菌 Lactobacillus casei 由来の L-LDH ( LCLDH ) はアロステリック型 L-LDH であるのに対して、 L. pentosus 由来の
L-LDH ( LPLDH ) は非アロステリック型の L-LDH である。このことは、細菌では L-LDH の調節特性が極めて多岐に分岐進化していること、そしてその調節特性はわずかなアミノ酸置換などの変異によって容易に変化しうるものであることを示唆している。そこで私たちはこの2つの
L-LDH に着目し、構造と機能の比較解析を通じてアロステリック特性を規定する要因を特定することにした。
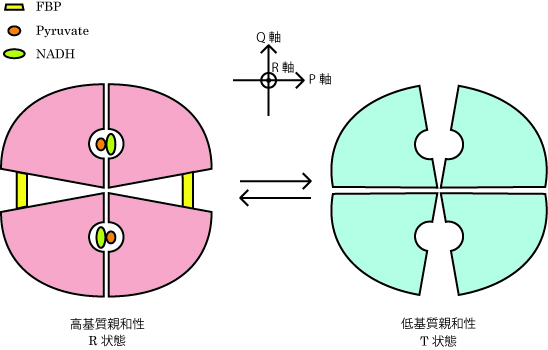
図2 FBPによるL-LDH活性化モデル
本研究室では、アロステリック型の LCLDH で、活性化状態と不活性化状態の2つの立体構造を明らかにした。得られた2つの構造はいずれも FBP などの調節因子を結合していないものであり、このことは LCLDH がこれらの因子と無関係に、活性型と不活性型両者の構造をとれることを示している。すなわち、LCLDH
のアロステリック効果は、Monod-Wyman-Changeux が提唱した協奏モデルに基本的に従うと考えられる。また、L-LDH は NAD や基質(類似体)が結合すると、それに伴ってコンホメーションが大きく変化するが、得られた構造はどちらもこれらを結合していないため、2つの構造の比較からアロステリック転移に本質的な構造変化だけが浮き彫りにされた。一方、非アロステリック型である
LPLDH の立体構造解析からは、活性中心である Arg171 とその周囲のアミノ酸残基との間に特異的な塩橋ネットワーク ( Arg171-Asp68-Lys235-Glu67-Lys178 ) が形成されていることが示され、このネットワークが
LPLDH を常に活性化された状態の構造に固定する役割を担っていることが示唆された。裏を返せば、LCLDH はこの塩橋ネットワークを持たないために、アロステリック調節に必要な構造の柔軟性を持つことができると考えられる。そこで、アミノ酸置換によって
LCLDH に塩橋ネットワークを導入したところ、LCLDH は FBP 非存在下でも高活性を発揮できる酵素へと変換された。この結果は、塩橋ネットワークの有無が、LPLDH と LCLDH の調節特性の相違に本質的に関与していることを裏付けるものと言える。しかし、この変異型
LCLDH も、pH が中性付近ではわずかながら FBP 依存性を残していたことから、アロステリック特性を規定する要因はこの塩橋ネットワーク以外にも存在することも示唆された。現在は別の領域にも変異を加えてより完全な非アロステリック型
LCLDH の作製を試みながら解析を進めている。
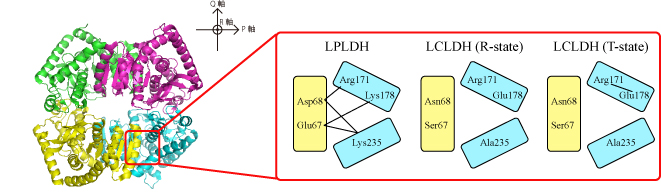
図3 塩橋ネットワーク
なぜLDHの研究をするのか?
近年、乳酸が生分解性バイオプラスチックの原料として脚光を浴びつつある。乳酸の合成には、化学的な手法と生物学的な手法と酵素学的な手法が考えられるが、化学的な手法は化石資源に依存するだけでなく、一般に L 型と D 型乳酸が混在したラセミ体を生成する欠点がある。ラセミ体乳酸はプラスチックの合成材料としては好ましくないため、それぞれの鏡像異性体に分離しなければならず、精製にコストがかかる。生物学的な手法は
L-LDH または D-LDH の遺伝子を保有する菌や酵母などを用いることで、一方の鏡像異性体乳酸を特異的に合成することができる。しかし、利用している生物を維持するためのコストがかかったり、老廃物など様々な不純物が混ざってしまう欠点がある。酵素学的な手法は生物学的な手法と同様、一方の鏡像異性体乳酸を特異的に合成することができるが、酵素が変性失活しやすいことや、触媒機能にや活性化因子を必要とすることなど、酵素特有の欠点がある。しかし、微生物の
LDH の性質は多様であり、それぞれの長所となる性質をうまく組み合わせることができれば、これまでになかった有用な LDH を作り出せる可能性がある。本研究室では、安定で、恒常的に高活性を発揮できるなどの有用な性質をもった LDH
を開発し、実用化するための基盤となる改変設計法の確立を目指している。また、将来的には乳酸だけでなく他の生分解性 2-ヒドロキシ酸も有用な材料となることも考えられるので、本研究室では、LDH の基質特異性を改変するための設計基盤の確立も合わせて目指している。
本研究室では、上記の LCLDH と LPLDH だけでなく、腸球菌 Enterococcus faecalis 由来の L-LDH ( EFLDH )、好熱性細菌 Thermus caldophilus 由来の L-LDH ( TCLDH )、海洋性乳酸菌 Marinilactobacillus sp. と Halolactibacillus miuraensis 由来の L-LDH ( MLLDH、HLLDH
)、放射線耐性菌 Deinococcus radiodurans 由来の L-LDH ( DRLDH ) を扱っている。これらのL-LDH はそれぞれ実用化する上で長所と短所がある。例えば TCLDH は現在知られている
L-LDH の中で最も熱安定性が高く、90 ℃ の熱処理に対しても耐えることができるという長所があるが、最適反応温度が高い上に FBP 要求性が高く、そのままでは利用コストがかかりすぎるという短所がある。このような性質がどのような要因によって規定されているのかが明らかになれば、それらをうまく組み合わせて実用的な
L-LDH を開発することができると考えられる。
D型乳酸脱水素酵素とギ酸脱水素酵素
酸塩基触媒基である His296 の近傍に存在する Glu264 は、その負電荷によってHis296の分極化を促進し、触媒機能を促進する。 Arg235 は基質と水素結合を形成することによって基質結合を安定化するとともに、結合した基質の分極化を促進し、補酵素と基質との間の水素転移を促進する。
Val78 と Gly79 の主鎖のアミド基は基質のカルボキシル基と水素結合を形成し、基質を安定化する。
これらのアミノ酸残基は D-2-ヒドロキシ酸脱水素酵素ファミリーに属する酵素間で保存されていることから、触媒機構は酵素間で共通していると考えられている。しかし、この酵素ファミリーには他の酵素とは大きく異なる反応を触媒する酵素も存在する。例えば、FDH
はNAD
+を補酵素としてギ酸を二酸化炭素に酸化する反応を触媒する酵素である。この触媒反応は炭素数が1のギ酸を基質とすること、酸化反応に大きく偏っていること、溶媒との間でプロトンの授受を行わない、つまり酸塩基触媒基を必要としないことなど、D-2-ヒドロキシ酸脱水素酵素ファミリーには特異的な性質を有している。
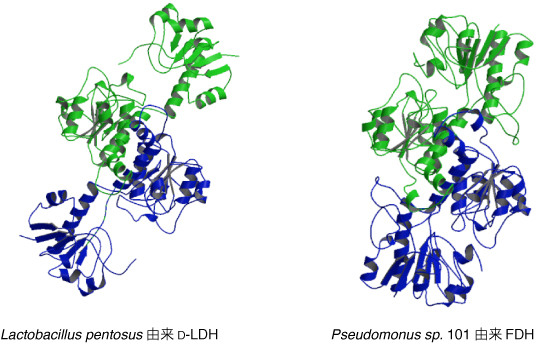
図4 FBPによるL-LDH活性化モデル
本研究室では、Lactobacillus pentosus 由来の D-LDH と、Pseudomonus sp. 101 由来の FDHの立体構造と活性中心モデルを基に、基質特異性や触媒機構を規定する要因を検討してきた。
まず、両者はともに活性部位にループ構造 (活性ループ) を有しているが、主鎖のコンフォメーションとその役割が大きく異なっていることを明らかにした。D-LDH の Val78 と Gly79 の主鎖アミド基は基質結合を安定化する役割を担うのに対して、FDH
でこれに相当する Ile122 と Gly123 は主鎖カルボニル基が基質の分極化を促進する役割を担う。これらのアミノ酸残基は、活性部位の反対側で、D-LDH では Asn97 側鎖と FDH では Glu141 側鎖と、それぞれ水素結合を形成していることから、この2つのアミノ酸残基が主鎖コンフォメーションと酵素反応における機能を規定する要因であることを明らかにした。すなわち、D-LDH
の Asn97 を Asp に置換した変異型 D-LDH のX線構造解析を行ったところ、活性ループのコンフォメーションが変化していた。そして、この変異に伴い、触媒の最大反応速度はあまり変化しなかったが、基質親和性は大きく低下した。一方、FDH
の Glu141 を Asn に置換したところ、D-LDH の場合と逆に、基質親和性は変化せず、最大反応速度が大きく低下した。さらに興味深いことに、変異型 FDH は、顕著なグリオキシル酸還元酵素活性を示した。すなわち、このわずか一残基置換で、FDH
が、D-LDH の仲間の2-ヒドロキシ酸脱水素酵素に置換されたことになる。
D-LDH では His296 が酸塩基触媒基として働き、溶媒とプロトンの授受を行っているのに対して、触媒基を必要としないFDH では、これに相当する残基
( His332 ) は基質との結合に関与している。D-LDH の His296 の近傍には Glu264 が存在するが、FDH ではこれに相当する残基が Gln ( Gln313 ) に置換されている。先に得られた Glu141Asn
変異型の FDH の Gln313 を Glu に置換したところ、FDH の活性がさらに低下したのに対して、グリオキシル酸還元活性はさらに大きく上昇した。すなわち、Glu-Gln間の置換が2-ヒドロキシ酸脱水素酵素と FDH
の機能を分岐させる第二の鍵であることが明らかになった。 さらに、D-LDH の基質認識機構を解明するために、立体構造に基づいて、Tyr52 残基を Leu に置換した。置換の結果、ピルビン酸に対する活性は大きく低下したのに対して、フェニルピルビン酸や
2-ケトカプロン酸などの大きな側鎖をもつ 2-ケト酸に対する活性が大きく増大し、野生型D-LDH のピルビン酸に対する活性をしのぐことになった。加えて、この残基を Val、Ala に置換した解析によって、この位置のアミノ酸側鎖のサイズや形状に応じて、2-ケト酸に対する基質特異性が変化することを明らかにした。
D-LDH のファミリーは多様な機能をもつ酵素を含んでいる。現在は、さらにこのファミリーの酵素群を比較検討し、D-LDH と FDH 双方に部位特異的変異を導入し、これらを様々な機能をもつ酵素へと改変する研究を進めている。
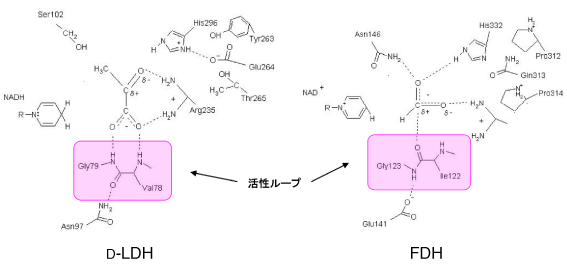
図5 D-LDHとFDHの反応スキーマ
なぜD-LDH、FDHの研究をするのか?
D-LDH は L-LDH と同様、生分解性プラスチックの原料である乳酸の酵素学的合成法への利用が期待されている。また、D-2-ヒドロキシ酸には有用物質が多く、これらを鏡像的に合成することができる D 型ヒドロキシ酸脱水素酵素は産業的な有用性が期待できる。一方、触媒反応に
NADH などの補酵素を必要とする酵素を無細胞系で工業的に利用するためには、反応の度に補酵素を補充しなければならず、コストがかさむというデメリットがある。FDH はギ酸を用いて NAD+ を還元すること、その反応が極端に偏っていること、生成物である二酸化炭素は簡単に除去できることなどの理由から、バイオリアクター内での NADH リサイクルシステムとしての利用が期待されている。D-LDH は FDH と同じ酵素ファミリーに属していることから、これら2種の酵素から得られてた知見は、相互にそれぞれをより有用な酵素へと改変するために応用できると考えられる。
D型マンデル酸脱水素酵素とは?
D 型マンデル酸脱水素酵素 ( D-ManDH ) は NAD(H) を用いてベンゾイル蟻酸とD 型マンデル酸の間の酸化還元反応を触媒する酵素の総称である。D 型マンデル酸は β-ラクタム系抗生物質の側鎖修飾剤として利用されていて、製薬の分野において需要が高い化合物である。しかし、かつてはシアン化水素を用いて化学的に合成しなければならなかったため、近年ではより安全に合成できる酵素学的手法による合成系が模索されるようになった。本研究室では、Enterococcus 属乳酸菌の一株に見いだされた D-ManDH を主な素材として研究を進めている。発見された D-ManDH は D 型マンデル酸に限らず、疎水性側鎖を有する D-2-ヒドロキシ酸に作用することが明らかになった。触媒反応の類似性から、当初は、D-ManDH
はD-LDH と同様、D-2-ヒドロキシ酸脱水素酵素ファミリーに属すると予測されたが、本研究室での解析の結果、既知のケトパント酸還元酵素 ( KPR ) とともに、D-LDH とは異なる新規の酵素ファミリーに属していることが明らかになった。これまで、疎水性側鎖をもつ
D-2-ヒドロキシ酸に作用する酵素は、D-LDH と同じ既知の酵素ファミリーの D-ヒドロキシイソカプロン酸脱水素酵素 ( D-HicDH ) が知られており、また本研究室では、一アミノ酸残基の置換によって D-LDH と D-HicDH
と同様な基質特異性の酵素を作り出すことにも成功している。しかし、これらの酵素は共通して基質の C3 位が直鎖状のものにしか作用することができなかった。これに対して、D-ManDH は C3 位が分岐鎖をもつ基質に対して高い活性を発揮できることができる。この点が従来のD-2-ヒドロキシ酸脱水素酵素ファミリーにはない、D-ManDH
の大きな特徴ということができ、今後、D-ManDH はだけでなく、その他の合成系においても利用できる可能性が期待できる。また、微生物のゲノム上にはD-ManDH のホモログが広く分布しており、それらの機能分岐にも興味が持たれる。
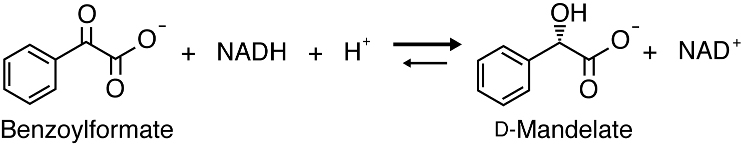
図6 D-ManDHの触媒反応
なぜD-ManDHの研究をするのか?
D-ManDH はD型マンデル酸合成系における利用が期待されているが、基質複合体の立体構造は不明であり、触媒残基や反応機構は明らかになっていない。そこで、まずは基質複合体の立体構造や反応機構を明らかにすることによって、D-ManDH を改良し、実用化することができると考えられる。また、D-ManDH
はパントテン酸生合成経路を担っている KPR に対して低い相同性がある。KPR は立体構造や反応機構など、様々な知見が得られている酵素であり、親水性側鎖を有する D-2-ヒドロキシ酸にしか作用しない性質をもつ。KPR において触媒に重要とされているアミノ酸残基の多くは
D-ManDH においても保存性が高いことから、KPR で得られている知見をもとに D-ManDH を解析すれば、基質側鎖認識メカニズムの解明や、より基質との反応性が高い D-ManDH の開発ができると考えている。
 東京理科大学 創域理工学部 生命生物科学科 中島研究室
東京理科大学 創域理工学部 生命生物科学科 中島研究室
 東京理科大学 創域理工学部 生命生物科学科 中島研究室
東京理科大学 創域理工学部 生命生物科学科 中島研究室
 私たちは、β-1,2-グルカンの合成が可能な酵素の発見を端緒にβ-1,2-グルカンの大量合成法を確立したことで、β-1,2-グルカン関連酵素群の探索を現在中心的に行っています。実際に、様々な新規のβ-1,2-グルカン関連酵素の発見を報告しており(主な成果のリスト)、2024年には植物病原菌の生産する病原性因子とされる糖鎖の合成酵素を同定したことが、化学系のトップジャーナルの一つであるJACSに掲載されました(論文、概要)。2026年1月時点で、β-1,2-グルカン関連酵素の研究をできているのはここだけだと思われます。また、ここからβ-1,2-グルカンとは異なる新たな糖鎖に作用する新たな酵素群の探索へも展開しつつあります。そういった意味で、当研究室は非常にオリジナル性の高い研究領域を持っているといえるでしょう。また、私たちの研究室では、X線結晶構造解析もメインの技術として取り扱っています。自分たちで発見した酵素について自分で構造解析まで行い、酵素がはたらく分子メカニズムを明らかにするというのはとても楽しいです。
私たちは、β-1,2-グルカンの合成が可能な酵素の発見を端緒にβ-1,2-グルカンの大量合成法を確立したことで、β-1,2-グルカン関連酵素群の探索を現在中心的に行っています。実際に、様々な新規のβ-1,2-グルカン関連酵素の発見を報告しており(主な成果のリスト)、2024年には植物病原菌の生産する病原性因子とされる糖鎖の合成酵素を同定したことが、化学系のトップジャーナルの一つであるJACSに掲載されました(論文、概要)。2026年1月時点で、β-1,2-グルカン関連酵素の研究をできているのはここだけだと思われます。また、ここからβ-1,2-グルカンとは異なる新たな糖鎖に作用する新たな酵素群の探索へも展開しつつあります。そういった意味で、当研究室は非常にオリジナル性の高い研究領域を持っているといえるでしょう。また、私たちの研究室では、X線結晶構造解析もメインの技術として取り扱っています。自分たちで発見した酵素について自分で構造解析まで行い、酵素がはたらく分子メカニズムを明らかにするというのはとても楽しいです。