講座紹介 GMP教育訓練コース
東京理科大学薬学部は日本で初めてGMPを体系的に学べる「GMP教育訓練コース」を設置しました。
設置の背景
2004年の薬事法改正で医薬品製造の全面委託が可能となり、製薬企業の製造販売部門と製造部門を切り離す分社化が進んだ結果、製造販売業者においてGQPで求められる製造所監査が出来る人材の不足が課題となっています。さらに2019年以降、ジェネリック医薬品企業等のGMP違反や不正問題が起こり、医薬品の供給不安にまで影響が及び、また、ワクチン等の国内製造強化の動きもあります。
今後、国内の医薬品産業の活性化、健全化に向けては適切なGMP人材育成が必須です。この課題に対応するため、我々は、EUの合理的な仕組みであるQualified Person(QP)制度で活用されているQP育成・資格取得コースを参考にしてGMP教育訓練コースの開講を進めてまいりました。
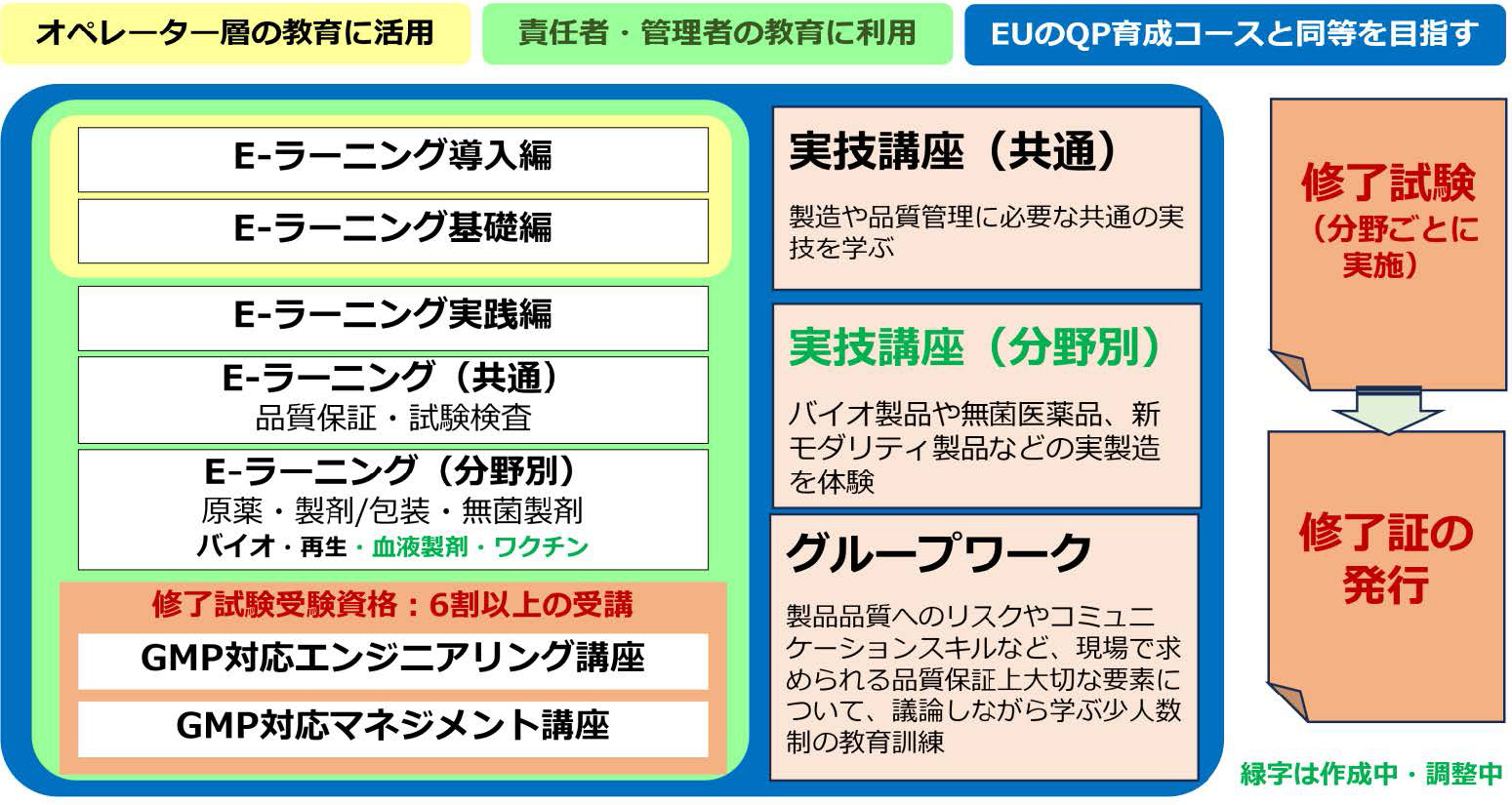
※E-ラーニングは株式会社じほうが提供する“e-GMP”(東京理科大学 薬学部医療薬学教育研究支援センターが監修)の活用を推奨します。
コース仕様
- 1.E-ラーニング(導入、基礎、実践、分野別)
- 2.GMP対応エンジニアリング講座(オンデマンド配信)
GMP対応マネジメント講座(オンデマンド配信) - 3.QAフォーラム
- 4.グループワーク
- 5.実技講座(環境、空調、無菌、消毒 など)
主な対象者
- 製造所の製造管理者やその候補となる品質保証部門(QA)等に従事する方
- 製造販売業者のGQP部門に従事する方
- 行政のGMP査察官
- これから製薬企業等でGMP、GQPの責任者、行政のGMP査察官を目指す学生
- 医薬品産業を支える施設・設備/機器関連企業や原材料メーカーに従事し、GMPについて深く学ぶ意思がある方 など
修了証の発行
現在、日本で医薬品製造管理者となるためには薬剤師資格が必要である一方で、薬学教育にはGMP教育が組み込まれておらず、本コースの役割は極めて重要と考えています。
必要な講義を受講し修了試験を受験していただくことで、修了証を発行します。
修了試験について
東京理科大学 薬学部医療薬学教育研究支援センターは、適切なGMP人材の育成を目的として、EUの合理的な仕組みであるQualified Person(QP)制度で活用されているQP育成・資格取得コースを参考にしてGMP教育訓練コースを設置し、GMP対応エンジニアリング講座及びGMP対応マネジメント講座を開講しています。各講座の受講生には受講証明書を発行しておりますが、この度、医薬品製造における高度な専門知識、医薬品の品質保証に係る知識・経験・洞察力・判断力を測 る修了試験を実施し、合格者には修了証を発行することとしました。
受験分野は、QA(一般)、QA(原薬)、QA(無菌)、QA(生物)、QA(再生)、QC責任者の6分野から選択して受験していただきます。
修了試験の要綱
- 実施日時
- 毎年6月後半に実施予定
- 会場
- 東京理科大学 神楽坂キャンパス 3号館教室(予定)(東京都新宿区神楽坂1-3)
- 対象
- 修了試験受験資格要件を満たしていること。
- 受験分野
-
6分野から受験したい分野を選択して受験申込してください。
分野ごとに試験問題が異なります。受験分野は、分野別①より1分野、分野別②より1分野選択することができます。
①または②から1分野のみ選択することも可能です。
分野別①:一般・無菌・QC責任者
分野別②:原薬・生物・再生医療 - 申込み
-
東京理科大学 薬学部医療薬学教育研究支援センターホームページ
https://sccper-tus.study.jp/ - 試験概要
- マークシート方式 60問(共通問題 40問、分野別問題 20問)
- 合格発表
-
毎年7月末
東京理科大学 薬学部医療薬学教育研究支援センターホームページにおいて発表します。
合格者には修了証を発行いたします。各自マイページよりダウンロードください。
修了試験受験要件を満たしていない場合は修了試験の得点にかかわらず不合格とします。
修了試験の活動報告ページへ
講座一覧
実技
その他
GMP基盤知識
GMP導入講座
-
方式
E-ラーニング
-
対象者
新任者、一般作業者(パート職員、派遣スタッフ)、QA・QCの若手から中堅者
-
特長
製造所に入る際の留意事項や、品質保証の重要性など”規制要件の手前にあるもの”と位置付けられるような内容を教育するための講座です。
-
講義一覧(10講義)
- 医薬品(クスリ)とは
- 医薬品の品質とは
- GMPとは
- 製造所に入る
- 製薬工場で働くということ
- 倉庫管理
- 医薬品を製造する
- 医薬品の包装・表示について
- 清掃とは
- 記録について
-
申込先
GMP基礎講座
-
方式
E-ラーニング
-
対象者
新任者、一般作業者(パート職員、派遣スタッフ)、QA・QCの若手から中堅者
-
特長
医薬品に携わるすべての人が知っておくべき、GMPの核となる基本知識を解説する講座です。
-
講義一覧(30講義)
- 医薬品等に関する規制
- GMPの基本
- 日本薬局方とは
- 医薬品GDPの基礎
- 手順書の重要性
- 記録の重要性
- 医薬品製品標準書とは
- 製薬工場における保管管理
- サンプリング
- 防虫・防鼠管理
- 製造管理とは
- 原材料の受け入れ
- 衛生管理
- データインテグリティとは
- ロットの基本構成
- バリデーション・キャリブレーション
- 品質試験とは
- 逸脱の検知と報告の重要性
- 医薬品の品質とその重要性
- 過去の薬害事件
- 医薬品の不正問題
- QA業務とは
- 製造・品質管理の記録類管理(発行・保管)
- 製造・品質管理の製造記録・品質記録の照査
- 品質情報および品質不良等の処理(苦情処理)
- CAPAの基礎
- 変更管理
- 逸脱管理
- 自己点検の基礎
- 査察対応の基本
-
申込先
GMP実践講座
-
方式
E-ラーニング
-
対象者
製造グループ管理者、QA・QCの若手・中堅・管理職・部長クラス
-
特長
実務者に必要なGMPの実践知識を解説するとともに、海外ガイダンスや査察対応、委託先GMP監査など、管理者レベルで求められる情報も幅広く解説する講座です。
-
講義一覧(33講義)
- 製造販売承認書~審査の流れと具体的記載内容の理解
- 医薬品の薬局等構造設備規則
- 日本薬局方 位置づけの理解と有効活用に向けて
- GQPについて
- 医薬品GDPの要点
- 医薬品製品標準書の記載事項理解
- 製造管理業務の実務知識
- 工程管理
- 製薬工場における不合格品等の取扱い
- 品質不良等の処理
- 構造設備・作業室の衛生管理
- 使用設備等の機能
- 作業者の健康管理・安全管理
- バリデーションの実務
- キャリブレーションの実務
- 共用設備の管理
- 交叉汚染の防止
- 製薬用水の基礎
- コンピュータ化システムについて
- CSVについて
- 委託先監査の留意点
- 教育訓練の重要性
- 変更・逸脱管理の手順とポイント
- CAPA実施のポイント
- 自己点検実施の留意点
- PIC/S GMPとは
- 海外規制当局査察
- 品質リスクマネジメントの基本
- 医薬品品質システムについて その1~医薬品品質システムの概要
- 医薬品品質システムについて その2~プロセスと組織の役割
- 品質マネジメントレビューについて
- 品質文化 その1~製薬企業の社会的責任
- 品質文化 その2~人的資源育成と組織マネジメント
-
申込先
GMP対応エンジニアリング講座
-
方式
オンデマンド配信
-
対象者
- 製造所の製造管理者やその候補となる品質保証部門(QA)等に従事する方
- 製造販売業者のGQP部門に従事する方
- 行政のGMP査察官
- これから製薬企業等でGMP、GQPの責任者、行政のGMP査察官を目指す学生
- 医薬品産業を支える施設・設備/機器関連企業や原材料メーカーに従事し、GMPについて深く学ぶ意思がある方 など
-
特長
GMP対応エンジニアリングのポイントについて、様々な観点から講座を実施します。
Q&Aは講義受講後Webで質問することが出来ます。
- 質問受付:Web受付(6月末・11月末 締切)
- 回答:Web公開(9月・3月 公開)
-
講義一覧(10講義)
- 品質リスクアセスメント編(共通)
- 製剤施設編(共通)
- 無菌製剤施設編
- 再生医療等製品の製造施設編
- コミッショニング及びクオリフィケーション編(共通)
- 空調システム編(共通)
- 製薬用水システム編(共通)
- コンピュータ化システム編(共通)
- 原薬製造施設編
- キャリブレーション編(共通)
-
チラシ
GMP教育訓練コース(GMP対応エンジニアリング講座)
-
申込先
受講申込みページの「GMP対応エンジニアリング講座」をご覧ください。
GMP対応マネジメント講座
-
方式
オンデマンド配信
-
対象者
- 製造所の製造管理者やその候補となる品質保証部門(QA)等に従事する方
- 製造販売業者のGQP部門に従事する方
- 行政のGMP査察官
- これから製薬企業等でGMP、GQPの責任者、行政のGMP査察官を目指す学生
- 医薬品産業を支える施設・設備/機器関連企業や原材料メーカーに従事し、GMPについて深く学ぶ意思がある方 など
-
特長
GMP対応マネジメント(GMPソフト面の管理)のポイントについて、様々な観点から講座を実施します。
グループワークは別途実施いたします。
Q&Aは講義受講後Webで質問することが出来ます。
- 質問受付:Web受付(6月末・11月末 締切)
- 回答:Web公開(9月・3月 公開)
-
講義一覧(12講義)
- 品質保証を実践する者の責務と最近の関連規制
- 監査マニュアル/不正製造の観点から
- 変更マネジメントと変更管理
- 製品品質照査とデータ処理
- 品質リスクマネジメントとバリデーション
- 承認事項の確認方法・出荷判定
- 技術移転・開発情報・知識入手の重要性
- 試験室管理/OOS、OOT、安定性モニタリング
- 医薬品品質システムと品質文化醸成の評価
- 逸脱管理とCAPA
- 委託先管理/原料の供給者管理
- コミュニケーションスキルの向上
-
チラシ
-
申込先
受講申込みページの「GMP対応マネジメント講座」をご覧ください。
グループワーク
-
方式
対面集合教育
-
対象者
- 製造所の製造管理者やその候補となる品質保証部門(QA)等に従事する方
- 製造販売業者のGQP部門に従事する方
- 行政のGMP査察官
- これから製薬企業等でGMP、GQPの責任者、行政のGMP査察官を目指す学生
- 医薬品産業を支える施設・設備/機器関連企業や原材料メーカーに従事し、GMPについて深く学ぶ意思がある方 など
-
特長
GMPに対応するマネジメント能力の向上を目指します。
製品品質へのリスクやコミュニケーションスキルなど、現場で求められる品質保証上大切な要素について議論しながら学ぶ少人数制の教育訓練です。
-
講義一覧(11講義)
- 監査マニュアル/不正製造の観点から
- 変更マネジメントと変更管理
- 製品品質照査とデータ処理
- 品質リスクマネジメントとバリデーション
- 承認事項の確認方法・出荷判定
- 技術移転・開発情報・知識入手の重要性
- 試験室管理/OOS、OOT、安定性モニタリング
- 医薬品品質システムと品質文化醸成の評価
- 逸脱管理とCAPA
- 委託先管理/原料の供給者管理
- コミュニケーションスキルの向上
-
チラシ
-
申込先
受講申込みページの「グループワーク」をご覧ください。
GMP分野別知識
QA講座
-
方式
E-ラーニング
-
対象者
QA部門所属の現場担当者から管理職クラスまで
-
特長
QA部門で必要な知識として、安定性モニタリングや外部委託業者の管理などに加え、査察対応についても解説する講座です。
-
講義一覧(16講義・予定)
- 製品品質の照査
- 知識管理
- KPIとは
- 安定性モニタリング
- 有害生物防除(Pest Control)
- 技術移転
- 製剤開発
- 原料等の供給者管理
- 外部委託業者の管理
- 委託先監査の実施について
- 製造所からの出荷管理
- 品質情報の措置と回収
- 医薬品の回収について
- 委託先監査実施の要点と責任者の役割
- 査察対応の注意点
- 海外当局からの査察対応
-
申込先
QC講座
-
方式
E-ラーニング
-
対象者
QC部門所属の現場担当者から管理職クラスまで
-
特長
QC部門における業務の基礎として、計測機器の校正や標準品の取り扱いなどの基本知識とともに、OOSやOOTへの対応など現場で必要となる知識を解説する講座です。
-
講義一覧(12講義・予定)
- 試験検査業務とは
- 計測機器の校正
- 標準品の取り扱い
- 試薬試液の管理
- 機器の日常点検、ログブック
- OOSの取り扱い(起きた時の対応)
- OOSの取り扱い(調査)
- 製造記録・品質記録の確認
- 参考品・保存品の保管
- データインテグリティについて
- OOTについて
- 試験方法の技術移管
-
申込先
原薬講座
-
方式
E-ラーニング
-
対象者
原薬製造に携わる方を対象に、若手・中堅から管理職クラスまで
-
特長
原薬製造の基礎知識から、不純物に関わるICHガイドライン等の内容まで網羅する講座です。
-
講義一覧(13講義・予定)
- 原薬の製造管理・品質管理
- 原薬GMPのガイドライン
- 洗浄バリデーション
- 原薬の包装
- 原薬のラペル
- リテスト
- 出発物質、中間体(重要中間体)
- 再加工、再処理
- マスターファイル
- 残留溶媒ガイドライン(ICH Q3C)
- 元素不純物ガイドライン(ICH Q3D)
- DNA 反応性(変異原性)不純物の評価及び管理ガイドライン(ICH M7)
- 原薬の交叉汚染防止
-
申込先
包装工程・固形製剤講座
-
方式
E-ラーニング
-
対象者
包装ラインに従事する現場担当者、管理者
-
特長
固形製剤、包装・表示に関する基礎知識、目視検査など、包装工程従事者に必要な基礎を解説する講座です。
-
講義一覧(12講義・予定)
- 固形製剤の処方設計及び変更
- 固形製剤の製造における留意点
- 固形製剤の製造設備・機器の構造と留意点
- 固形製剤のユーティリティー(空調、水、環境)の留意点
- 固形製剤の技術移転の留意点
- 固形製剤の検査機の取扱い
- 表示・包装管理とは
- 医薬品の法定表示について
- 資材の員数管理(添付文書)
- ラインクリアランス
- 固形製剤の異物対策と外観検査
- 限度見本とその取り扱い
-
申込先
無菌医薬品講座
-
方式
E-ラーニング
-
対象者
無菌医薬品製造に携わる方を対象に、若手・中堅から管理職クラスまで
-
特長
無菌医薬品製造の基礎知識から、微生物の汚染・増殖防止策までを解説する講座です。
-
講義一覧(14講義・予定)
- 無菌医薬品の製造管理・品質管理
- 作業環境の清浄度管理
- 微生物の汚染・増殖(1)~まず把握すべき基本事項
- 無菌性保証の原則
- 滅菌方法(湿熱滅菌)
- 滅菌バリデーション~湿熱滅菌を例に
- 無菌操作法
- ろ過滅菌
- 培地充填試験
- 無菌製剤の検査機の取り扱い
- 微生物の汚染・増殖(2)〜環境モニタリング・サンプリング等による管理の基本
- 無菌医薬品製造に関するガイドライン
- 無菌性保証の本質~無菌とは何かを的確に理解する
- 微生物の汚染・増殖(3)~逸脱・不備事例も交えて学ぶ
-
申込先
バイオ医薬品講座
-
方式
E-ラーニング
-
対象者
バイオ医薬品製造に携わる方を対象に、若手・中堅から管理職クラスまで
-
特長
バイオ医薬品製造に関する法的要件や製造上の基礎知識、品質管理で重要となる微生物・ウイルス汚染の対策までを解説する講座です。
-
講義一覧(9講義)
- 製造用細胞とは
- タンパク質の変性 -基本事項-
- タンパク質の変性と品質確保上の留意点
- ウイルス汚染、増殖とは
- ウイルス汚染への対処と汚染防止対策
- ウイルスクリアランス試験
- ウイルス不活化と除去
- 生物由来原料基準の基本事項
- 生物由来原料基準に即した原料取扱いの要点
-
申込先
再生医療等製品講座
-
方式
E-ラーニング
-
対象者
再生医療等製品の製造に携わる方を対象に、初任者から中級者まで
-
特長
再生医療等製品を製造するうえで特有の「細胞」に関する知識や、関連法規制の基本的事項を解説する講座です。
-
講義一覧(6講義)
- 再生医療に用いる細胞の基礎知識
- 再生医療に用いる細胞の特徴と変化
- 再生医療におけるウイルス安全性の考え方
- 再生医療等製品に関する規制
- 再生医療における体細胞と幹細胞の取り扱い
- 再生医療等製品におけるベリフィケーション
-
申込先
実技
実技講座
-
方式
主に座学・実地演習・ワークショップ
-
対象者
医薬品製造施設に従事する製造管理者、QA担当者、GQP品質保証責任者等
-
特長
製造所の要である品質保証担当者(QA)は“抜群な”知識が必要であり、それは座学のみで習得できるものではありません。実際の作業を体験し、また、その専門家から原理・原則を学ぶ機会を提供いたします。
-
講義一覧(順次追加)
-
環境維持のためのGMP実践トレーニング
アース環境サービス株式会社
-
防虫・防鼠/清掃・消毒/環境モニタリング 実践プログラム
イカリ消毒株式会社
-
空調システム 実技講座
三機工業株式会社
-
再生医療等製品の品質保証・製造体験
ミナリスアドバンストセラピーズ株式会社
-
無菌医薬品製造工程 実技講座(ろ過滅菌工程)
メルク株式会社
-
-
チラシ
GMP教育訓練コース(実技講座)
-
申込先
受講申込みページの「実技講座」をご覧ください。
その他
QAフォーラム
-
方式
ハイフレックス方式
-
概要
東京理科大学薬学部「医薬品等品質・GMP講座」では、品質保証担当者(QA)等の育成を意図したGMP対応エンジニアリング講座(10講座)及びGMP対応マネジメント講座(12講座)を開講しており、これら講義の1年のまとめとしてQAフォーラムを開催しています。昨年度は「第2回QAフォーラム」を2025年3月14日に開催し、QAの主要な業務である出荷可否決定、欧州のQP制度やQP育成の教育システムなど、QA担当者に理解していただきたいことについて著名な先生方に講義を行っていただきました。
第3回QAフォーラムは2026年3月13日開催を予定しています。
-
チラシ

![各講座のご案内は[受講申込み]ページから](./images/common/guidance_button_pages.svg)

